
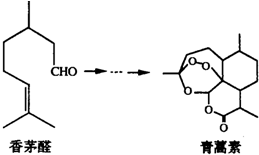
| A. | 青蒿素易溶于水,更易溶于乙醇等有机溶剂中 | |
| B. | 向香茅醛中滴加溴水后溴水褪色,证明香茅醛中含有碳碳双键 | |
| C. | 香茅醛与青蒿素均能发生氧化、取代、加成、聚合反应 | |
| D. | 香茅醛的同系物中,含4个碳原子的有机物有3种(不考虑立体异构) |
分析 A.青蒿素含有酯基,具有酯的性质;
B.香茅醛中醛基可被溴水氧化;
C.青蒿素不含碳碳双键,不能发生聚合反应;
D.含4个碳原子的同系物中含有碳碳双键和醛基.
解答 解:A.青蒿素含有酯基,具有酯的性质,不溶于水,故A错误;
B.香茅含有碳碳双键和醛基,醛基可被溴水氧化,不能证明含有碳碳双键,故B错误;
C.青蒿素不含碳碳双键,不能发生聚合反应,故C错误;
D.含4个碳原子的同系物中含有碳碳双键和醛基,对应的结构有CH2=CHCH2CHO、CH3CH=CHCHO、CH3C(CHO)=CH2,共3种,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重学生的分析能力的考查,注意把握有机物的官能团与性质的关系,易错点为D,注意同分异构体的判断,题目难度不大.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
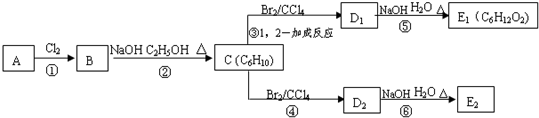
 .
.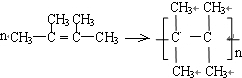 .
.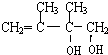 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 | B. | CaF2 | C. | NO2 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
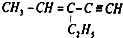 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 3,3,6 | B. | 2,3,5 | C. | 2,5,4 | D. | 4,6,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ 1s22s22p6 | B. | Br 1s22s22p63s23p63d104s24p5 | ||
| C. | O2- 1s22s22p6 | D. | Cr ls22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1+Q2>4Q3 | |
| B. | Q1+Q2<Q3 | |
| C. | 1mol氧气和2mol氢气的总能量高于1mol水的总能量 | |
| D. | 1mol氧气和2mol氢气的总能量低于1mol水的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaHCO3溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com