
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
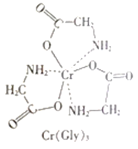
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
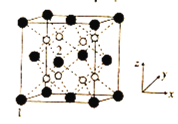
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
【答案】3d54s1 4s 铬的价电子数比钾的多,原子半径比钾的小,铬的金属键比钾的强 N、O N 直线 sp ![]()
![]()
![]() a
a
【解析】
根据原子的核电荷数和能级图书写价电子排布式并分析失电子情况;根据配合物的组成结构分析;根据价层电子对数目和价层电子对互斥理论分析原子的杂化类型和空间构型;根据晶胞结构利用均摊法分析晶体的化学式并进行相关计算。
(1)基态Cr原子的核电荷数为24,其电子排布式为1s22s22p63s23p63d54s1,则价电子排布式为3d54s1;Cr成为阳离子时首先失去4s轨道的电子;
(2)铬与钾均位于第四周期,铬的价电子数比钾的多,原子半径比钾的小,铬的金属键比钾的强,则铬的熔点和沸点均比钾的高;
(3)由甘氨酸铬的结构可知,N、O原子提供孤对电子,形成配位键,则配合物的配位原子是N、O;
(4)①KSCN的四种组成元素K、S、C、N中,K是金属元素,第一电离能最小,C、N、O三种元素为同周期的主族元素,第一电离能随核电荷数增大而呈增大趋势,但N原子的2p轨道为半充满结构,相对稳定,三种元素的第一电离能由小到大的顺序为C<O<N,O、S同主族,O的非金属性强,第一电离能大,即O>S,则K、S、C、N四种元素的第一电离最大的是N元素;KSCN中SCN-离子中C原子价层电子对个数是2+![]() =2,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为直线形,其中C原子杂化方式为sp;
=2,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为直线形,其中C原子杂化方式为sp;
②NO2的结构可表示为![]() 则NO2的大π键可表示为
则NO2的大π键可表示为![]() ;
;
(5)①立方CrO2晶体的晶胞中含有黑球原子数目为8×![]() +6×
+6×![]() =4,白球数为8,则黑球为Cr,共含有4个CrO2,晶胞的质量为
=4,白球数为8,则黑球为Cr,共含有4个CrO2,晶胞的质量为![]() g=
g=![]() g,晶胞的体积为(a×10-10cm)3,则CrO2的密度
g,晶胞的体积为(a×10-10cm)3,则CrO2的密度![]() =
=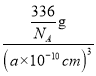 =
=![]() g·cm-3;
g·cm-3;
②在CrO2晶胞中1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),说明晶胞的边长单位为1,则原子坐标为(
),说明晶胞的边长单位为1,则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )分别为晶胞结构
)分别为晶胞结构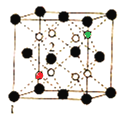 中的红色球和绿色球,两者之间的距离为晶胞体对角线的
中的红色球和绿色球,两者之间的距离为晶胞体对角线的![]() ,即为
,即为![]() pm=
pm=![]() a pm。
a pm。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B.CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为![]()
C.标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D.常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为__。
(2)碳可以形成多种有机化合物,如图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
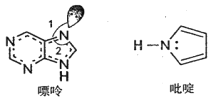
①嘌呤中所有元素的电负性由大到小的顺序__。
②吡啶结构中N原子的杂化方式是___。
③NH3的键角__PH3的键角,理由是__。
④分子中的大π键可以用符号π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
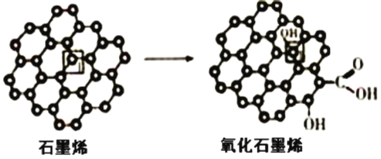
石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是__(填“变大”、“变小”“不变”)。
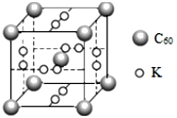
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为anm该化合物中K原子和C60分子的个数比为___,该晶体的密度ρ=___g/cm3(阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是

A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,![]() 与
与![]() (均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,
,![]() 的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
(3)某化学社团的同学对仅由两种元素组成的化合物X进行研究,实验过程形成如图示:
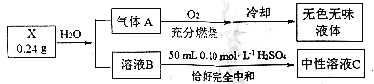
已知:A为单质,B的焰色反应只显示黄色。
写出X与水反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们能组成一种化合物,其结构如图所示。下列说法正确的是( )
![]()
A.原子半径:![]()
B.W与Z形成的化合物![]() 中只含离子键
中只含离子键
C.最高价氧化物对应水化物的酸性:![]()
D.W的单质难溶于W与X形成的化合物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(![]() )的性质与氨气相似,将pOH相同、体积均为
)的性质与氨气相似,将pOH相同、体积均为![]() 的CH3NH2H2O和
的CH3NH2H2O和![]() 两种溶液分别加水稀释至体积为V,pOH随
两种溶液分别加水稀释至体积为V,pOH随![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
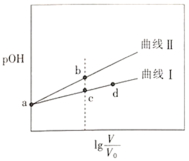
已知:常温下,![]() ,pOH=-lgc(OH-)。
,pOH=-lgc(OH-)。
A.稀释相同倍数时,CH3NH2H2O的浓度比![]() 的浓度大
的浓度大
B.溶液中水的电离程度:b点大于c点
C.由c点到d点,溶液中![]() 保持不变
保持不变
D.常温下,某盐酸的![]() ,a点时CH3NH2H2O的
,a点时CH3NH2H2O的![]() ,当
,当![]() 时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
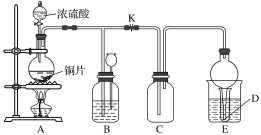
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:_____________________________。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是______________________。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)______________。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是____________________。B中应放置的液体是________(填字母)。
A 饱和Na2SO3溶液 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸还未能使Cu完全溶解。你认为原因是______________________。
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是________(填字母)。
A Fe B BaCl2溶液 C Ag D Na2CO3溶液
(4)实验中该同学向A中反应后溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是__________(填名称),反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是
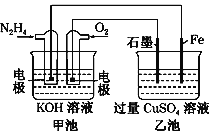
A. 乙池中Fe电极上发生氧化反应
B. 乙池中石墨电极上发生的反应可写为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com