
| n |
| V |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | O3 | 水 | 硫酸 | 纯碱 | 胆矾 |
| B | 黄铜 | NO2 | 盐酸 | 石灰水 | FeSO4 |
| C | 碘酒 | 一氧化碳 | 磷酸 | NH3?H2O | 食盐 |
| D | H2 | Fe3O4 | HNO3 | 烧碱 | 小苏打 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
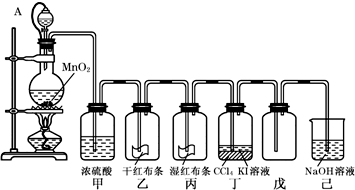
科目:高中化学 来源: 题型:

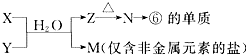
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
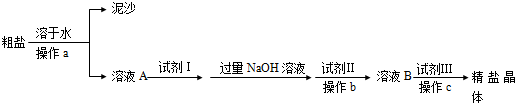
科目:高中化学 来源: 题型:
| 3 |
| 5 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
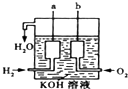 (1)把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成2mol C,测得D的平均反应速率为0.15mol/(L?min),则
(1)把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成2mol C,测得D的平均反应速率为0.15mol/(L?min),则查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| 试剂A |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com