
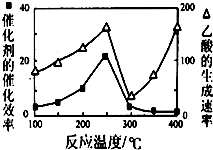
 ����CH4��CO2���������ֵ���ߵĻ�ѧ��Ʒ����֪���з�Ӧ��
����CH4��CO2���������ֵ���ߵĻ�ѧ��Ʒ����֪���з�Ӧ������ ��1��������֪�Ȼ�ѧ����ʽ�ʹ����Ȼ�ѧ����ʽ���ݸ�˹���ɽ��
��2���ݷ�Ӧ����������֪���������ѭ������������Ϊ������̼����ԭ���غ���д��ѧ����ʽ��
��3�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ������¶����߶�������������ʽ��ͣ�
���¶����ߣ���ѧ��Ӧ���ʼӿ죮
��� �⣺��1����֪��CH4��g��+2O2��g��?CO2��g��+2H2O��g����H1=a kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H2=b kJ/mol
��2CO��g��+O2��g��?2CO2��g����H3=c kJ/mol
�ݸ�˹���ɣ���+2����-2���۵ã�CH4��g��+CO2��g��?CO��g��+2H2��g����H=��a+2b-2c��kJ/mol��
�ʴ�Ϊ��a+2b-2c��
��2���ݷ�Ӧ����������֪���������ѭ������������Ϊ������̼����ԭ���غ���д��ѧ����ʽΪ��3CO+3H2�TCH3OCH3+CO2��
�ʴ�Ϊ��3CO+3H2�TCH3OCH3+CO2��
��3�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ������¶����߶�������������ʽ��ͣ��ʴ�Ϊ�������Ĵ�Ч�ʽ��ͣ���ѧ��Ӧ���ʽ��ͣ�
���¶����ߣ���ѧ��Ӧ���ʼӿ죬�ʴ�Ϊ���¶����ߣ���ѧ��Ӧ���ʼӿ죮
���� ���⿼���˸�˹���ɵ�Ӧ�á�������ԭ��Ӧ����ʽ��д��Ӱ�췴Ӧ���ʵ����أ��ۺ��Ե��Ƚ����ף���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܵ�Һ̬�������÷�Һ�ķ������� | |
| B�� | �������ܵ�Һ̬�������÷�Һ�ķ������� | |
| C�� | �е㲻ͬ��Һ̬������������ķ������� | |
| D�� | �Ȼ��ƺ�����ͭ�γɵĻ��������ܽ⡢���ˡ�������˳����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����2SO2��g��+O2��g��?2SO3��g����H=-QkJ/mol��Q��0��������һ�ܱ������м���1molSO2��0.5molO2��ַ�Ӧ�ų�������Ϊ0.5QkJ | |
| B�� | �Ȼ�ѧ����ʽ�еĻ�ѧ��������ʾ��Ӧ���ʵ����ʵ����������÷�����ʾ | |
| C�� | ��Ҫ���Ȳ��ܷ����ķ�Ӧ��һ�������ȷ�Ӧ | |
| D�� | С�մ���ˮ�еĵ��뷽��ʽ��NaHCO3�TNa++H++CO${\;}_{3}^{2-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �轺��ף�������ʳƷ������ʹ��������� | |
| B�� | �����պ�����ζ�ķ���������֯��ʹ�ë֯�� | |
| C�� | ��SO2Ư���IJ�ñ���վû��ɫ | |
| D�� | ������������ˮ�����ļ���ɱ��Ч�����ڶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
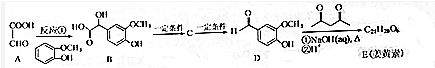
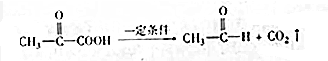


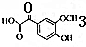
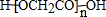
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K��K+ | B�� | Na+��Mg2+��Al3+ | C�� | Na+��F- | D�� | Cl-��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ѧ��ӦN2��g��+3H2��g��=2NH3��g���������仯��ͼ��ʾ����ش��������⣺
��ѧ��ӦN2��g��+3H2��g��=2NH3��g���������仯��ͼ��ʾ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ʒ����ʴ��ǿ��˵�����Ļ�ѧ���ʲ����� | |
| B�� | ��ѧ��Ӧ���ʵĵ�λ��ʱ�䵥λ�����ʵ�����λ���� | |
| C�� | ���Ӽ��ı����Ǿ������ã�ֻ�ܴ����������������ӹ��ɵ������� | |
| D�� | �ɽ����������������гɷ�ĩ��ʹ����ˮ��Ӧ��ʵ�����ȫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | 1.8��l0-5 | 4.9��l0-10 | K1=4.3��l0-7 K2=5.6��l0-11 |
| A�� | �����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��NaCN����pH��Na2CO3����pH��CH3COONa�� | |
| B�� | a mol•L-1 HCN��Һ��b mol•L-1 NaOH��Һ�������Ϻ���������Һ��c��Na+����c��CN-������a���ܴ���b | |
| C�� | ����������μ�ˮ������Һ�ĵ����ԡ�����ĵ���Ⱦ���������С | |
| D�� | NaHCO3��Һ�У�һ������c��Na+��=c��HCO3-��+2c��CO32-��+c��H2CO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com