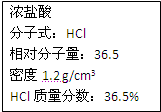
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
mol/L.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
.(填序号)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl
-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为 0.30mol/L稀盐酸.
①该学生需要量取
mL上述浓盐酸进行配制.
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是
.
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200mL 0.30mol/L的盐酸与50mL 0.80mol/L CaCl
2溶液混合(体积变化忽略不计),所得溶液中Cl
-的物质的量浓度是
mol/L;向所得混合溶液中加入5.3g Na
2CO
3固体,充分反应后,溶液中生成沉淀的质量有
g.
(5)在标准状况下,将
L HCl气体溶于1000mL水中(水的密度为1g/cm
3),所得盐酸的密度为1.2g/cm
3,溶质质量分数为36.5%.(保留小数点后一位).
(6)某温度下,将Cl
2通入NaOH溶液中,反应得到NaClO、NaClO
3的混合溶液,经测定ClO
-与ClO
3-的浓度之比为1:3,则Cl
2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
.



 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: