
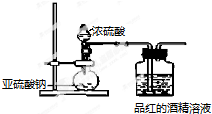
| ͬŨ����Һ | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | ��ɫ�ٶ� |
| Na2SO3��Һ | �� | �� | �� | �� |
| NaHSO3��Һ | �������� | ������� | ������� | �� |
���� ��1������ʵ��Ŀ�ļ�������������ʷ�������ȡ����������Ҷ��������ж���Ӧ��β������װ�ã�
��2�����ݶ��������ˮ��Ӧ�ķ���ʽ�ж���Һ�д��ڵ�����ע����������ˮ�ķ�Ӧ�ǿ��淴Ӧ��
��3��������������ʷ�����ǿ���������ܷ���ˮ�����������ᣬ�ݴ��ж�����
��4���������ƺ����������ƶ���ǿ�������Σ����ܷ���ˮ�⣬���������Ƶ�ˮ��̶ȴ������������Ƶ�ˮ��̶ȣ�ע���������Ƕ�Ԫ���ᣬ����������������ܷ�������ˮ�⣬ֻ�ǵ�һ��ˮ��̶ȴ��ڵڶ���ˮ��̶ȣ�
��� �⣺��1����ʵ����̽�������SO2�ܲ���ʹƷ����ɫ�����Զ�������ͨ��Ʒ����ҺǰҪ���и�����������ж������Զ������岻��ֱ���ſգ���Ҫ��β������װ�ã�
�ʴ�Ϊ����������û�и����ȱ�ٶ�������ĸ���װ�ã���û��β������װ�ã�
��2�����������ˮ��Ӧ���������ᣬ�������Ƕ�Ԫ���ᣬ�����ܷ����������룬��һ�����������Ӻ�������������ӣ�������������ӵ�����������������Ӻ������ӣ�SO2+H2O?H2SO3��H2SO3?H++HSO3-��HSO3-?H++SO32-����Щ��Ӧ���ǿ��淴Ӧ�����Դ��ڵĺ�����Ԫ�ص����У������������⣩H2SO3��HSO3-��SO3 2-��
�ʴ�Ϊ��H2SO3��HSO3-��SO3 2-��
��3���������ƺ����������ƶ���ǿ�������Σ����ܷ���ˮ�⣬ˮ�ⷴӦ����ʽΪ���������Ƶ�ˮ�⣬SO32-+H2O=HSO3-+OH-��HSO3-+H2O=H2SO3+OH-�����������Ƶ�ˮ�⣬HSO3-+H2O=H2SO3+OH-��ͨ��ˮ�ⷽ��ʽ�����������������ƻ������������ƶ���ˮ�����������ᣬ�ʸ�˵������
�ʴ�Ϊ������ȷ��������������Ӻ�������������Ӷ���ˮ�����������
��4�����������ƺ����������ƶ��ܵ����ˮ�⣬������̶ȴ���ˮ��̶ȣ�ˮ�������ģ���������������ܵ��������������ӣ�������������������������Һ�е�����������ӱ�����������Һ�е��٣�������������Һ�е�������������ӱ�����������Һ�еĶࣻ����������ӵ�ˮ��̶ȴ���������������ӵ�ˮ��̶ȣ�������������ӵĵڶ���ˮ�����������������������Һ�е������������������Һ�еĶ࣮
�ʴ�Ϊ���٣��ࣻ�࣮
�ڸ���ʵ��ͷ������ó��Ľ�����ʹƷ����ɫ����������������ӣ�
�ʴ�Ϊ����Ҫ��SO32-��Ư�����ã�
���� ���⿼���˶�������Ư���Ե�̽��ʵ�飬��Ŀ�Ѷ��еȣ�ע��������ǿ�������λ���ǿ����������ˮ��Һ�ж��ǵ���Ϊ����ˮ��Ϊ�Σ������ˮ�������


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������ᷴӦ CO32-+2H+=CO2��+H2O | |
| B�� | ������������ͭ��Һ�� Fe+3Cu2+=2Fe3++3Cu | |
| C�� | ������ͭ�����ᷴӦ OH-+H+=H2O | |
| D�� | ������Ȼ�����Һ��Ӧ Ba2++SO42-=BaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǻ�ú��ʹ��������Ӳ�ȵ�ˮ��������Ϊ���ܳ�ȥˮ�е�Ca2+��Mg2+��SO42-��Cl-�� | |
| B�� | ���ǻ�ú������������ˮ��Na+Ũ������ | |
| C�� | �ǻ�úʹӲˮ�����Լ��ǻ�ú�������������ֲ���������ͬһ���ӽ�������ͬʱ���� | |
| D�� | ʧȥ����Ӳˮ�����Ļǻ�ú�������ָܻ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1•min-1 | B�� | 0.2 mol•L-1•min-1 | ||
| C�� | 0.3 mol•L-1•min-1 | D�� | 0.6 mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com