
| A、若无固体剩余,则溶液中一定有Fe3+ |
| B、若溶液中有Cu2+,则一定没有固体析出 |
| C、若有固体存在,则溶液中一定有Fe2+ |
| D、若溶液中有Fe2+,则一定有Cu析出 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取 NaOH固体20.0 g |
| B、将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH |
| C、滴定管的0刻度线在上部,而量筒的0刻度线在下部 |
| D、在配制一定物质的量浓度的溶液时,定容后,经摇匀后发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度持平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A) |
| B、c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) |
| C、c(H+)+c(A2-)=c(OH-)+c(H2A) |
| D、c(Na+)=c(HA-)+c(H2A)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
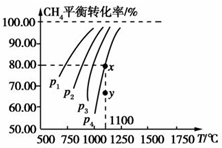 在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H>0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃,P1时该反应平衡常数约为16.4 |
| D、压强为p4时,在y点:V正>V逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com