
分析 (1)根据盐的概念可知,盐是由金属阳离子和酸根离子形成的一类化合物(注意铵盐中不含有金属阳离子)来解答;非电解质相对于电解质而言,电解质:在水溶液里或熔融状态下能导电的化合物.非电解质:在水溶液里或熔融状态下都不能导电的化合物.该概念的前提必须是化合物;
(2)依据阿伏伽德罗定律以及其推论回答即可;
(3)一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子;一水合氨与稀硫酸反应生成(NH4)SO4;
(4)根据n=$\frac{v}{{v}_{m}}$、c=$\frac{n}{V}$计算;
(5)根据反应中元素化合价的变化分析;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子.
解答 解:(1)A.NH3无金属离子、铵根离子,属于氢化物,不符合盐的概念,不属于盐,NH3是化合物,溶于水和水结合成一水合氨,一水合氨电离,一水合氨是电解质,NH3不电离,属于非电解质;
B.NH3•H2O无金属离子、铵根离子,属于碱,不属于盐,属于弱电解质;
C.NH4NO3含有铵根离子,属于盐,属于强电解质;
D.HNO3无金属离子、铵根离子,属于酸,属于电解质;
E.N2单质,不符合盐的概念,不属于盐,不属于电解质;
故答案为:C;A;
(2)0.1mol的N2H4气体和0.2molNH3气体,它们在同温、同压下的体积比即是它们的物质的量之比:0.1mol:0.2mol=1:2,所含的原子数比为:(1×6):(2×4)=6:8=3:4,
故答案为:1:2;3:4;
(3)一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,一水合氨与稀硫酸发生酸碱中和反应生成盐(NH4)SO4和水,
故答案为:NH3•H2O?NH4++OH-;( NH4)2SO4;
(4)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,则n(NH3)=0.1mol,所以c=$\frac{n}{V}$=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2;
(5)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2,反应中N元素化合价升高,则氨气为还原剂,氯气中氯元素的化合价降低,氯气为氧化剂;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子,所以1.5mol氧化剂氯气参与反应,则发生转移的电子的物质的量为3mol;当8molNH3参加反应时有2mol被氧化,转移电子为6mol,
所以转移3mol电子时,被氧化的氨气为1mol;
故答案为:NH3;3;1.
点评 本题考查了弱电解质的电离方程式的书写,物质的量浓度计算,氧化还原反应中电子的转移原子守恒的应用等,涉及的知识点较多,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只有(1) | B. | (1)(2) | C. | (2)(3)(4) | D. | (1)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); 和
和 ; ⑧
; ⑧ 和
和  .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

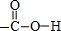
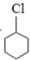 $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$Y$\stackrel{④}{→}$
$\stackrel{③}{→}$Y$\stackrel{④}{→}$
| 反应① | 反应② | 反应③ | |
| 试剂及条件 | |||
| 反应类型 |
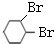 +2NaOH $→_{△}^{醇}$
+2NaOH $→_{△}^{醇}$ 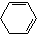 +2NaBr+2H2O
+2NaBr+2H2O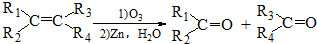 (R1、R2、R3、R4为烃基或H)
(R1、R2、R3、R4为烃基或H) $→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,
$→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料的燃烧反应都是放热反应 | |
| B. | 一定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 加热后才能发生的化学反应是吸热反应 | |
| D. | 放热反应的逆反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8s | B. | 10s | C. | 12s | D. | 14s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的物质的量浓度c=$\frac{1000a(M-18n)}{MV}$mol/L | |
| B. | 饱和溶液中溶质的质量分数w=$\frac{a(M-18n)}{M(a+b)}$% | |
| C. | 25℃时R的溶解度S=$\frac{100a(M-18n)}{18na+Mb}$g | |
| D. | 饱和溶液的密度ρ=$\frac{a(M-18n)}{a+b}$g/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com