
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
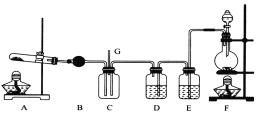
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
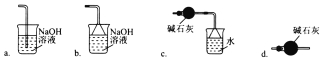
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
【答案】(1)MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ (2)饱和食盐水 (3)c
Mn2++2H2O+Cl2↑ (2)饱和食盐水 (3)c
(4)NCl3+3H2O=NH3↑+3HClO (5)在低于95℃条件下,水浴加热蒸馏(收集70℃馏分)
(6)①c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) ②减小 ③![]()
【解析】
试题分析:(1)根据装置图可判断,F装置是制取氯气的装置,因此烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑。
Mn2++2H2O+Cl2↑。
(2)浓盐酸易挥发,生成的氯气中含有氯化氢和水蒸气等杂质,应该先用饱和食盐水除去氯化氢杂质,然后再除去水蒸气,因此E中盛有饱和食盐水。
(3)氯气有毒,需要尾气处理。氨气又极易溶于水,需要防止倒吸,根据装置图可知只有c既能吸收可能过量的氯气和氨气,又能防止水进入C装置。
(4)能使湿润的红色石蕊试纸变蓝色的气体为NH3,根据原子守恒可知反应中还有次氯酸生成,反应的化学方程式为NCl3+3H2O=NH3↑+3HClO。
(5)由于NH4Cl能在NCl3中溶解,而NCl3沸点比较低易挥发,因此采用蒸馏的方法。但由于高于95℃时NCl3易爆炸,因此采用水浴加热的方法进行蒸馏,且蒸馏时需要控制温度介于70~95℃之间。
(6)①由于一水合氨的碱性强于氢氧化铝,则铵根的水解程度小于铝离子的水解程度,二者水解均显酸性,因此硫酸铝铵溶液中离子浓度大小关系为c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,由于氨水是弱碱,抑制水的电离,则在此过程中水的电离程度减小。
③a mol NH4Al(SO4)2加入到b L c mol/L的氨水中,所得溶液呈中性,铝离子与氨水发生反应,铝离子完全沉淀。根据电荷守恒2c(SO42-)+c(OH-)=c(NH4+)+c(H+)>可知c(NH4+)=2c(SO42-)=![]() 。根据氮原子守恒可知amolNH4Al(SO4)2提供的N原子为amol,bL氨气提供的N原子为bcmol,因此混合溶液中以NH3·H2O形式存在的N原子为(a+bc-4a)mol=(bc-3a)mol,混合溶液中c(NH3·H2O)=
。根据氮原子守恒可知amolNH4Al(SO4)2提供的N原子为amol,bL氨气提供的N原子为bcmol,因此混合溶液中以NH3·H2O形式存在的N原子为(a+bc-4a)mol=(bc-3a)mol,混合溶液中c(NH3·H2O)=![]() ,所以一水合氨的电离常数K=
,所以一水合氨的电离常数K=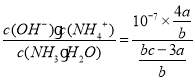 =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 工业上通过分离液态空气获得其单质。原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是(写元素符号)_____ ,
画出D离子的结构示意图__________________ 。
(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式_ 。
(3)对元素B的单质或化合物描述正确的是 _。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称) _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
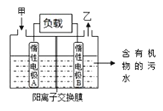
A.B电极为正极
B.气体乙可能为CO2
C.O2在A电极得电子
D.电池工作时,B电极附近的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
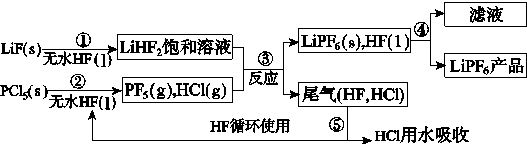
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
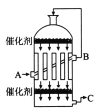
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为_________________;该反应在___________________(填设备名称)中进行。
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的______(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_______(填设备名称)中用______吸收,得到浓硫酸或发烟硫酸。
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是___________。

(4)欲提高SO2的反应速率和转化率,下列措施可行的是__________(填选项字母)。
A.向装置中通入氮气且保持体积不变 B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂 D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500![]() L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.锌与稀硫酸的反应既是氧化还原反应,又是 反应(填“放热”或“吸热”,实验室可将该反应设计成原电池,应采用 作为负极材料,正极的电极反应式为 ,若有1mol电子流过导线,理论上正极产生的气体在标准状况下的体积是 L。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
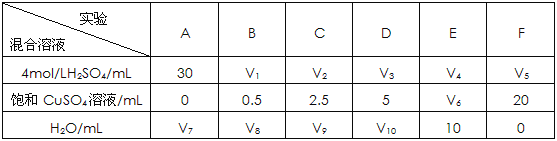
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

回答下列问题:
(1)下列有关说法正确的是 。
A.S2、S4、S6、S8互为同系物 B.S8转化为S6、S4、S2属于物理变化
C.不论哪种硫分子,完全燃烧时都生成SO2 D.常温条件下单质硫为原子晶体
E.32gS8单质含有的S—S键个数为NA
(2)在一定温度下,测得硫蒸气的平均摩尔质量为80g/mol,则该蒸气中S2分子的体积分数不小于 。
(3)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1mol产物的数据)。

①写出表示S8燃烧的热化学方程式_____________。
②写出SO3分解生成SO2和O2的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是___________________________;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________极;Ⅰ口排出的是__________(填“淡水”或“浓水”).
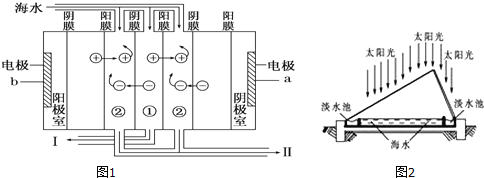
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是__________________________;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为_______________________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________________;
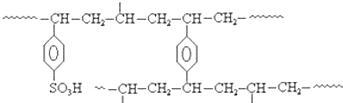
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____________反应得到的.自来水与该离子交换树脂交换作用后显____________(填“酸性”、“碱性”或“中性”).
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________(填阴离子符号)引起的,经___________(填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
查看答案和解析>>
科目:高中化学 来源: 题型:
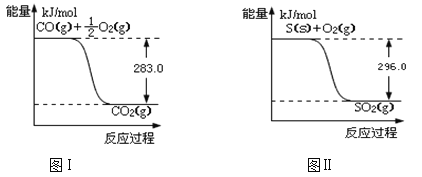
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
回答下列问题:
(1)SO2(g) + 2CO(g) ![]() S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。

已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com