
【题目】下表中的实线表示元素周期表的部分边界,a-j分别表示周期表中对应位置的元素。回答下列问题:

(1)请在上表中用实线补全元素周期表边界_______。
(2)元素b在元素周期表中的位置是_______;元素a与d形成的4核18电子物质的分子式_______。
(3)元素e、g、h的简单离子半径由小到大的顺序为______。(用离子符号表示)
(4)元素e的气态氢化物比元素i的气态氢化物稳定性______。(填“强”或“弱”)。
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为 ______。
(6)用电子式表示元素i、j形成化合物的过程______________________。
【答案】 略 第二周期第IVA 族 H2O2 Al3+ F- S2- 强 离子键和共价键 ![]()
【解析】根据元素周期表的结构可知:a为H元素、b为C元素、c为N元素、d为O元素、e为F元素、f为Na元素、g为Al元素、h为S元素、i为Cl元素、j为Ca元素;
(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下: ;
;
(2)元素b为碳,在元素周期表中的位置是第二周期第IVA 族;元素H与O形成的4核18电子物质为过氧化氢,其的分子式为H2O2;
(3)F-与Al3+的离子结构相同,核电荷数大离子半径小,另外S2-比F-多一个电子层,离子半径大,则元素e、g、h的简单离子半径由小到大的顺序为Al3+<F- <S2-;
(4)氟的非金属性比氯元素强,则元素e的气态氢化物比元素i的气态氢化物稳定性强;
(5)元素O与元素Na形成的化合物中,原子个数1:1的化合物为Na2O2,是离子化合物,所含化学键类型为离子键和共价键;
(6)CaCl2为离子化合物,其电子式形成过程为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某糕点主要由面粉、花生油和鸡蛋清焙制而成。下列说法正确的是
A. 该糕点不含糖类物质
B. 淀粉与葡萄糖互为同分异构体
C. 淀粉、油脂和蛋白质都能水解
D. 淀粉、油脂和蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含氧元素的化合物就一定是氧化物
B. 由不同种元素组成的纯净物就是化合物
C. 溶于水后得到的溶液能导电的物质是电解质
D. 只含有一种元素的物质不可能是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下:
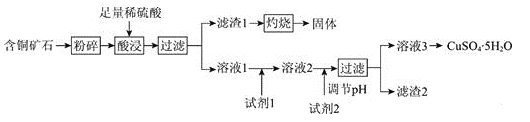
已知:
ⅰ.溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
ⅱ.相关试剂成分和价格如表1所示。
ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。
表1
试剂 | 成分 | 价格/(元·吨-1) |
漂白液 | 含25.2%NaClO | 450 |
双氧水 | 含30%H2O2 | 2400 |
浓硝酸 | 含98%HNO3 | 1500 |
表2
氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
(1)FeCu4SiO5(OH)4用氧化物的形式可表示为________。
(2)结合题中信息,所选用的试剂1的名称为________;加入该试剂时,所发生反应的离子方程式为________。
(3)加入试剂2,需调节溶液的pH的合理范围为________。试剂2可以选择下列物质中的________(填字母)。
A.Cu B.CuO
C.Cu(OH)2 D.Fe
(4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=________。
(5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632×104C的电量时,理论上阴极质量增加________g。(已知:1个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关水解原理的应用,下列说法正确的是
A.将NaHCO3溶液蒸干并灼烧时,HCO3-+H2O![]() H2CO3+OH-向正向移动,最后可以得到NaOH固体
H2CO3+OH-向正向移动,最后可以得到NaOH固体
B.MgSO4酸性溶液中含有杂质离子Fe2+时,可以先加人氯水将Fe2+氧化成Fe3+,再加入MgO除去杂质
C.为抑制离子的水解,在配制SnCl2溶液时,可以加入适量稀硫酸加以酸化
D.用MgCl2 6H2O制取无水MgCl2时,需要在HCl气流中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. ![]() 的NH4NO3溶液中氮原子数小于0.2NA
的NH4NO3溶液中氮原子数小于0.2NA
B. 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH-
C. 在O2参加的反应中,1mol O2作氧化剂时得到的电子数一定是4NA
D. 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充分反应时转移的电子数为1.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com