
足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的( )
|
| A. | MgO | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
| 弱电解质在水溶液中的电离平衡;化学反应速率的影响因素. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,以此来解答. |
| 解答: | 解:根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量, A、氧化镁和酸反应生成氯化镁和水,影响氢气的生成,故A错误; B、加入NaOH,发生酸碱中和反应,减少氢气的生成,故B错误; C、加入K2CO3固体,与盐酸反应生成二氧化碳,减少氢气的生成,C错误; D、加入CH3COONa,与盐酸反应生成醋酸,氢离子浓度减小而不改变氢原子子的总物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,故D正确; 故选:D. |
| 点评: | 本题以化学反应来考查影响反应速率的因素,明确氢离子浓度减小是减慢反应速率的关系,D选项为学生解答中的易错点. |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
在一密闭容器中进行反应:
2SO2(g)+O2(g)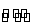 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.(已知﹣OH,﹣COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
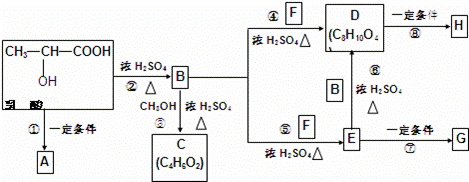
(1)推断结构简式,C: ;F: .
(2)B中所含的官能团有 ;反应③的反应类型是 .
(3)反应①的化学方程式为 .
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知胆矾失水的化学反应方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低.Q1与Q2的关系是(Q1、Q2为正数)( )
|
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4( g )+4NO2( g )═4NO( g )+CO2( g )+2H2O( g )△H=﹣574kJ•mol﹣1
②CH4( g )+4NO( g )═2N2( g )+CO2( g )+2H2O( g )△H=﹣1160kJ•mol﹣1.
下列正确的选项是( )
|
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=﹣867kJ•mol﹣1 |
|
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2mol |
|
| C. | 若0.2mol CH4还原NO2至N2,在上述条件下放出的热量为173.4kJ |
|
| D. | 若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
|
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 |
|
| B. | 由C(石墨)→C(金刚石)△H=+119kJ•mol﹣1可知,金刚石比石墨稳定 |
|
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 |
|
| D. | 在稀溶液中,H+(aq)+OH﹣(aq)═(H2O)(l)△H=﹣57.3kJ•mol﹣1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3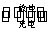 Na2S4+3NaBr
Na2S4+3NaBr
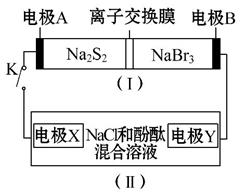
当闭合K时,X极附近溶液先变红色。下列说法中正确的是 ( )
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-====3NaBr
C.X电极的电极反应式为2Cl--2e-====Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就放出标准状况下的气体1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
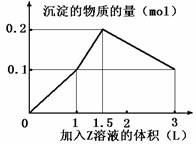
某混合溶液中, 含溶质X、Y各0.1 mol, 向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图, 则符合条件的X、Y、Z分别是( )
A.氯化铝、 氯化铁、 氢氧化钠
B.氯化铝、 氯化镁、 氢氧化钠
C.偏铝酸钠、 氯化钡、 硫酸
D.偏铝酸钠、 氢氧化钡、 硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com