
| A.[Na+]>[HCO3-]>[H+]>[OH-] |
| B.[Na+]+[H+]=[OH-]+[HCO3-]+2[CO32-] |
| C.[Na+]=[HCO3-]>[OH-]>[H+] |
| D.[Na+]=[HCO3-]+[CO32-] +[H2CO3] |
 CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-;溶液中存在Na+,HCO3-,CO32-,OH-和H+等五种离子,根据阴、阳离子的电荷守恒,B选项正确。由于HCO3-的水解程度大于其电离程度,即[OH-]>[H+],则A不正确。由于HCO3-的水解,使得[Na+]>[HCO3-],故C不正确。又根据NaHCO3中Na+与HCO3-的个数比为1:1,根据原子守恒:[Na+]=[HCO3-]+[CO32-] +[H2CO3],D正确
H2CO3+OH-;溶液中存在Na+,HCO3-,CO32-,OH-和H+等五种离子,根据阴、阳离子的电荷守恒,B选项正确。由于HCO3-的水解程度大于其电离程度,即[OH-]>[H+],则A不正确。由于HCO3-的水解,使得[Na+]>[HCO3-],故C不正确。又根据NaHCO3中Na+与HCO3-的个数比为1:1,根据原子守恒:[Na+]=[HCO3-]+[CO32-] +[H2CO3],D正确

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.盐AX和BY没有发生水解,盐AY和BX发生了水解 |
| B.酸性HX>HY,碱性AOH>BOH |
| C.等物质的量的AY和BX的混合物溶于水,溶液呈中性 |
| D.等物质的量浓度的HX溶液和HY溶液的pH前者大于后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+] |
| B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-] |
| C.[OH-]=[H+]+[HCO3-]+[H2CO3] |
| D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(OH-)<c(H+) | B.c(CH3COOH)+c(CH3COO-)=0.2mol/L |
| C.c(CH3COOH)>c(CH3COO-) | D.c(CH3COO-)+c(OH-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)<c(OH-)<c(CH3COO-)<c(Na+) |
| B.c(H+)<c(OH-)<c(Na+)<c(CH3COO-) |
| C.c(H+)<c(CH3COO-)<c(OH-)<c(Na+) |
| D.c(OH-)<c(CH3COO-)<c(H+)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸式盐的水溶液一定显碱性 |
| B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 |
| C.纯水呈中性是因为水中氢离子的物质的量浓度和OH-离子的物质的量浓度相等 |
| D.NaHCO3溶液的PH大于Na2SO4溶液的PH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(HCOO-)>c(Na+) | B.c(HCOO-)<c(Na+) | C.c(HCOO-)=c(Na+) | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O)+c(OH-) |
| D.点d所示溶液中:c(SO42-)>c(NH3?H2O)>c(OH-)>c(NH4+) |
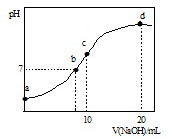
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com