
【题目】下列说法正确的是
A.25℃时,将pH=a的一元强酸溶液与pH=14﹣a的一元碱溶液等体积混合后,所得溶液呈酸性或中性
B.向醋酸钠溶液中加盐酸至溶液呈中性,则c(Clˉ)=c(CH3COOH)
C.常温下,已知CH3COOH的电离平衡常数为Ka、CH3COONa的水解平衡常数为Kh、则Ka·Kw=Kh
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液中c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
【答案】B
【解析】
A.25℃时,若碱为一元弱碱,则pH=14-a的该碱浓度要大于pH=a的一元强酸,所以等体积混合是碱过量,溶液显碱性,故A错误;
B.向醋酸钠溶液中加盐酸至溶液呈中性,溶液中存在电荷守恒c(Clˉ)+ c(OHˉ)+ c(CH3COOˉ)= c(H+)+ c(Na+),溶液显中性,所以c(OHˉ)= c(H+),则c(Clˉ)+(CH3COOHˉ)= c(Na+),溶液中同时存在物料守恒c(CH3COOH)+(CH3COOˉ)= c(Na+),所以有c(Clˉ)=c(CH3COOH),故B正确;
C.CH3COOH的电离平衡常数Ka=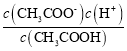 ,CH3COONa的水解平衡常数为Kh=
,CH3COONa的水解平衡常数为Kh=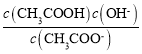 ,所以Ka·Kh= Kw,故C错误;
,所以Ka·Kh= Kw,故C错误;
D. NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,此时溶液呈酸性,需要再滴加少许NaOH呈中性,所以c(Na+)> c(![]() ),而溶液中存在电荷守恒c(Na+)+c(
),而溶液中存在电荷守恒c(Na+)+c(![]() )+c(H+)= 2c(
)+c(H+)= 2c(![]() )+c(OH-),溶液呈中性所以c(Na+)+c(
)+c(OH-),溶液呈中性所以c(Na+)+c(![]() )=2c(
)=2c(![]() ),所以c(Na+)> c(
),所以c(Na+)> c(![]() )>c(
)>c(![]() ),故D错误;
),故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个
①pH=0的溶液中Fe3+与S2因发生双水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)Ag+(aq)+Cl(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤![]() 和
和![]() 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,![]() 将增大
将增大
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
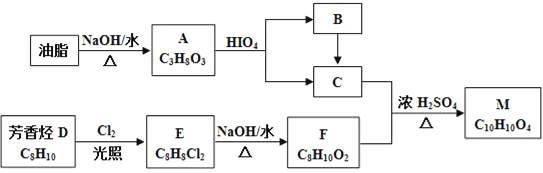
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③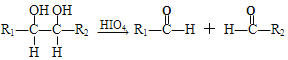
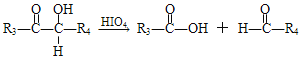
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
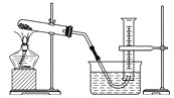
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )
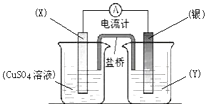
A. 电极X的材料是铜
B. 电解质溶液Y是硝酸银溶液
C. 银电极为电池的正极,发生的电极反应为:Ag++e﹣═Ag
D. 盐桥中的阳离子向硫酸铜溶液中移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
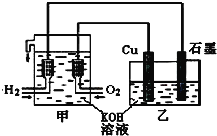
A.乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O
B.甲中通入氧气的电极为负极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5mol电子,可制得0.5molCu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
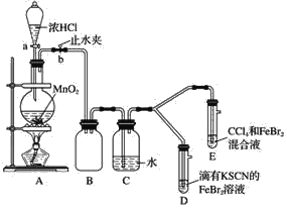
(1)①装置A中发生反应的离子方程式是______________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。已知:①Cu2++4NH3H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂);②已知装置A、C中所用硫酸的浓度相同,装置B、D中所用金属锌的质量完全相同
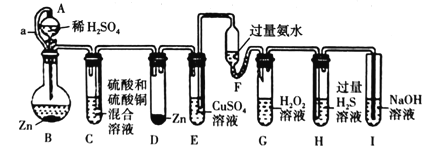
下列说法错误的是( )
A.该实验成功的关键条件是整套装置的气密性良好
B.因为形成原电池,所以装置D中生成氢气的反应速率一定大于B
C.导管a的作用是平衡A和B内气压
D.装置H中出现浅黄色浑浊,可证明非金属性:O>S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com