
��ͨ����н�������ʵ�飬����˵������ȷ���ǣ� ��
���� |
|
| |
���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ�����������������ɫ���� |
A��I����������ɫ��Ϊ����ɫ�Ļ�ѧ����ʽ��2NO��O2===2NO2
B��II�е�����˵��Fe�����γ����ܵ�����Ĥ����ֹFe��һ����Ӧ
C���Ա�I��II�е�����˵��ϡHNO3��������ǿ��ŨHNO3
D�����III�е�������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{83}^{209}$Bi ��${\;}_{83}^{210}$Bi������83������ | |
| B�� | ͬλ�أ�H2��D2��T2 | |
| C�� | H2O��NH3�����о�����ͬ���������͵����� | |
| D�� | ϡ�������ԭ������㶼�ﵽ8�����ȶ��ṹ���ʶ������������ʷ�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�켪��ʡ�����ϵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��������ʵ�������ȷ����
A����FeBr2��Һ��ͨ�������Cl2��2Fe2����2Br����2Cl2===2Fe3����Br2��4Cl��
B����ʳ�׳�ȥˮ���ڵ�ˮ����CaCO3+2H+ = Ca2++CO2��+H2O
C��KHCO3����������ʯ��ˮ��Ӧ��HCO3��+Ca2++OH��=CaCO3��+H2O
D����ǿ������Һ�У��������ƽ�Mn2��������MnO2��Mn2��+ClO��+H2O��MnO2��+Cl��+2H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡɽһ�����ϵڶ���ͳ�⻯ѧ�Ծ��������棩 ���ͣ�ʵ����
NaCl��NaClO�����������¿ɷ�����Ӧ��ClO�� + Cl�� + 2H+ = Cl2��+ H2O��ijѧϰС�����о�����Һ����Ҫ�ɷ�ΪNaCl��NaClO���ı��������
��1��������Һ��NaClO�����տ����е�CO2����NaHCO3��HClO�����ʡ�д���˻�ѧ��Ӧ����ʽ ��
��2��ȡ��������Һ�����Թ��У���������һ��Ũ�ȵ����ᣬ������ų���ͨ������װ�ü�������ijɷֿ����ж�����Һ�ı��������
��ѡ�Լ�Ϊ��98%Ũ���ᡢ1%Ʒ����Һ��1.0 mol��L��1 KI-������Һ��1.0 mol��L��1NaOH��
����ʯ��ˮ������NaCl��Һ
���������̽��ʵ�鷽����
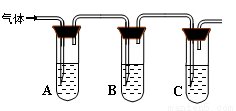
�����Լ� | Ԥ������ͽ��� |
�Թ�A�м������� �� �Թ�B�м�1%Ʒ����Һ�� �Թ�C�мӢ� �� | ��A����Һ����ɫ��B����Һ����ɫ��C����Һ����ǡ�������Һ���ֱ��ʣ� �� ������Һδ���ʣ� �� ������Һ��ȫ���ʡ� |
��3���õζ����ⶨ����Һ��NaClO��Ũ�ȡ�ʵ�鲽�����£�
�� ��ȡ 25.00 mL����Һ������ƿ�У����������a mol��L��1 Na2SO3��Һb mL��
�� �ζ���������c mol��L��1������KMnO4��Һװ�� ������ʽ���ʽ���ζ����У�KMnO4��ʣ���Na2SO3������Ӧ������Һ����ɫ���dz��ɫ���ұ��ְ�����ں�ɫ����ʱ��ֹͣ�ζ�����¼���ݡ��ظ��ζ�ʵ��2�Σ�ƽ����������KMnO4��Һv mL��
�ζ��������漰�ķ�Ӧ�У�NaClO+Na2SO3=NaCl+Na2SO4��
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
�� ��������Һ��NaC lO��Ũ��Ϊ mol��L��1���ú�a��b��c��v�Ĵ���ʽ��ʾ����
lO��Ũ��Ϊ mol��L��1���ú�a��b��c��v�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡɽһ�����ϵڶ���ͳ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪W��X��Y��ZΪ������Ԫ�أ�ԭ��������������W��Zͬ���壬X��Y��Zͬ���ڣ�����ֻ��XΪ����Ԫ�ء�����˵��һ����ȷ���ǣ� ��
A. ԭ�Ӱ뾶��X��Y��Z��W
B. W�ĺ���������Ա�Z�ĺ����������ǿ
C. W����̬�⻯����ȶ���С��Y����̬�⻯����ȶ���
D. ��W��Xԭ��������Ϊ5�����γɻ�����Ļ�ѧʽΪX3W2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡɽһ�����ϵڶ���ͳ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�����ʵ�����п��ϡHNO3��Ӧ��������Ļ�ԭ����ΪN2O����Ӧ������п��ʣ�࣬��μӷ�Ӧ��HNO3�б���ԭ��HNO3��δ����ԭ��HNO3�����ʵ���֮���ǣ� ��
A��1��4 B��1��5 C��2��3 D��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��һ9���¿���ѧ���������棩 ���ͣ������
��Ba��OH��2��Һ����μ���ϡ���ᣬ������������⣺
��1��д����Ӧ�����ӷ���ʽ__________________��
��2��������������£����ӷ���ʽ�루1����ͬ����__________������ţ���
A����NaHSO4��Һ�У���μ���Ba��OH��2��Һ����Һ������
B����NaHSO4��Һ�У���μ���Ba��OH��2��Һ��SOǡ����ȫ����
C����NaHSO4��Һ�У���μ���Ba��OH��2��Һ������
����A��������Һ�У������μ�Ba��OH��2��Һ���˲���Ӧ�����ӷ���ʽΪ��________________

��3������������ϡ����ֱ�����������������л����Һ�ĵ����������õ���ǿ��I��ʾ���ɽ��Ƶ�������ͼ�е� ���߱�ʾ������ţ���
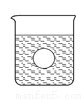
��4������һ����⻬������С��������Ba��OH��2��Һ���룬��ͼ��ʾ������ձ��ﻺ��ע����Ba��OH��2��Һ���ܶȵ�ϡ������ǡ����ȫ��Ӧ���ڴ�ʵ������У�С�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
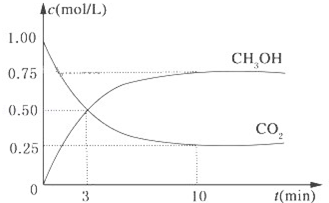 ���ʹ�����CO2�ĺ�������Ч�ؿ������� CO2��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
���ʹ�����CO2�ĺ�������Ч�ؿ������� CO2��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ/mol�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
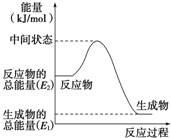 �״������ǿ��������õ�һ������Դ����֪��
�״������ǿ��������õ�һ������Դ����֪���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com