
【题目】氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:![]()
(1)N原子最外层电子有______种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________。
(2)![]() 的电子式为______________。
的电子式为______________。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________。
(4)上述该反应的平衡常数表达式为____________________________________。
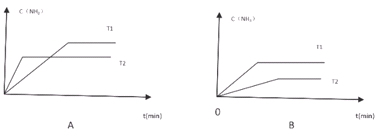
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________。
(6)T1温度在2L,容器中,当平衡时测得![]() 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得![]() 为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
【答案】5种 ![]()
![]() 氯原子结构与硫原子电子层数相同,但氯原子比硫原子多一个电子,原子半径氯原子小,更容易得到电子,因此氯元素的非金属性比硫强
氯原子结构与硫原子电子层数相同,但氯原子比硫原子多一个电子,原子半径氯原子小,更容易得到电子,因此氯元素的非金属性比硫强 ![]() B = 因为
B = 因为![]() ,始终
,始终![]() ,温度不变,K不变,所以
,温度不变,K不变,所以![]()
【解析】
根据核外电子排布规律分析原子核外电子的运功状态;根据物质的组成及性质分析判断晶体类型;根据共价化合物的成键特点书写电子式;根据反应方程式书写平衡常数表达式,根据勒夏特列原理分析判断平衡的移动方向。
(1)N原子最外层电子排布式为2s22p3,s轨道上的2个电子自旋相反,运动状态不同,p轨道有3种方向,所以有3种运动状态,即N原子最外层电子共有5种运动状态;上述平衡中物质,NH3和HCl常温下为气态,属于分子晶体,NH4Cl为离子化合物,在固态时属于离子晶体,故答案为:5;NH4Cl;
(2)NH3中N原子与H原子以共价键结合,电子式为![]() ;
;
(3)由于氯原子结构与硫原子电子层数相同,但氯原子比硫原子多一个电子,原子半径氯原子小,更容易得到电子,因此氯元素的非金属性比硫强;
(4)化学平衡常数表达式为各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,则上述该反应的平衡常数表达式为![]() ;
;
(5)A图中,T2时先达到平衡,温度越高,反应越快,则T2大于T1,上述反应为吸热反应,则升高温度,平衡向正方向移动,c(NH3)应增大,所以A图错误;B图中T1先达到平衡,说明T1大于T2,升高温度时,平衡向正方向移动,c(NH3)增大,所以B图正确,故答案为B;
(6)因为![]() ,始终c(NH3)=c(HCl),温度不变,K不变,所以
,始终c(NH3)=c(HCl),温度不变,K不变,所以![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 在蒸馏水中加入NH4NO3固体,Kw不变
B. 加水稀释FeCl3溶液,c(Fe3+)/ c(Cl-)的值减小
C. 加热蒸干并灼烧Al(NO3)3溶液得到Al(OH)3固体
D. 浓度均为0.1 mol·L-1的Na2CO3和NaHCO3的混合溶液中:3c(Na+)=2[c(CO32- )+c(HCO3-)+ c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
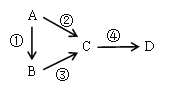
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志,长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6),下列说法正确的是_________(错选倒扣分)。
A.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇[CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖,请预测木糖醇的一种化学性质:_________;
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物 A,A 的实验结果如下:
Ⅰ.通过样品的质谱测得 A 的相对分子质量为 60
Ⅱ.核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目,例如:乙醇(CH3CH2OH) 有三种氢原子(图1),经测定,有机物 A 的核磁共振氢谱示意图如图:
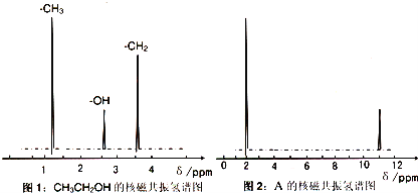
Ⅲ.将 A 溶于水,滴入石蕊试液,发现溶液变红,试推导写出 A 的结构简式为________ ;
(4)糖尿病人宜多吃蔬菜和豆类食品.蔬菜中富含纤维素,豆类食品中富含蛋白质,下列说法错误的是:_________(填序号,错选倒扣分);
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用.乙烯是香蕉的催熟剂,可使溴的四氯化碳溶液褪色,试写出该反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中![]() 和
和![]() 物质的量百分含量分别是10%和6%,发生反应为:
物质的量百分含量分别是10%和6%,发生反应为:![]() ,在其他条件相同时,测得试验数据如下:
,在其他条件相同时,测得试验数据如下:
压强( | 温度(℃) | NO达到所列转化率所需时间(s) | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A.温度越高,越有利于NO的转化
B.增大压强,反应速率变慢
C.在![]() 、90℃条件下,当转化率为98%时反应已达平衡
、90℃条件下,当转化率为98%时反应已达平衡
D.如进入反应塔的混合气体为![]() ,如速率
,如速率![]() 表示,则在
表示,则在![]() 、30℃条件下,转化率从50%增至90%时段,NO的反应速率为
、30℃条件下,转化率从50%增至90%时段,NO的反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-=![]() +3H2O。
+3H2O。
(1)负极上的电极反应为________。
(2)正极上的电极反应为________。
(3)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(4)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加徳罗常数的值,下列说法正确的是
A.12g石墨烯(单层石墨)中含有六元环的个数为2NA
B.标准状况下,22.4LHF中含有的氟原子数目为NA
C.密闭容器中,lmolNH3和lmolHC1反应后气体分子总数为NA
D.在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com