
分析 (1)放热反应的△H<0;
(2)根据燃烧热的定义判断;
(3)10g H2为5mol,结合热化学方程式计算;
(4)利用盖斯定律,将④-$\frac{1}{2}$③可得CO的燃烧热的热化学方程式;
(5)利用盖斯定理,将(①+②)×(-1)可得H2O(l)=H2O(g)△H.
解答 解:(1)放热反应的△H<0,则①③④属于放热反应,故答案为:①③④;
(2)1mol氢气完全燃烧生成液态水放出的热量为燃烧热,由①可知燃烧热为285kJ/mol (或△H=-285kJ/mol),故答案为:285kJ/mol (或△H=-285kJ/mol);
(3)10g H2为5mol,由燃烧热为285kJ/mol 可知放出的热量为5mol×285kJ/mol=1425 kJ,故答案为:1425 kJ;
(4)利用盖斯定律,将④-$\frac{1}{2}$③可得CO的燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.1kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.1kJ/mol;
(5)利用盖斯定理,将(①+②)×(-1)可得H2O(l)=H2O(g)△H=+43.2 kJ/mol,故答案为:+43.2 kJ/mol.
点评 本题考查热化学方程式的意义、燃烧热的定义等,为高频考点,侧重考查学生的分析能力和计算能力,难度不大,注意燃烧热是指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
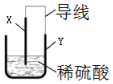 某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )
某课外小组利用废旧金属器件制作一个简易的铜锌原电池,为确保实验安全设计了如图装置,则下列说法正确的是( )| A. | 该装置将电能转化为化学能 | B. | 电子从电极X转移到电极 Y | ||
| C. | X为阳极,表面产生大量气泡 | D. | Y为负极,电极反应为Zn-2e→Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| B. | 手机外壳上铁的碳纤维外模是一种新型的无机非金属材料 | |
| C. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| D. | 浊液、胶体,溶液三种分散系的本质区别是能否产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 摩1,3-丁二烯分子中含有共价键数为5.5N0 | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9N0 | |
| C. | 1 mol-OH和1 mol OH-所含电子数都为9N0 | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 所有原子都在同一平面上 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑥⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
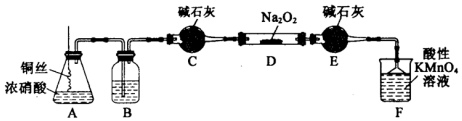
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMn04溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com