
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
分析 (1)①Cl原子核外有17个电子,其3s、3p能级电子为其价电子;M层有1个3s、3个3p、5个3d轨道;
②根据价层电子对互斥理论确定离子空间构型、B原子的杂化轨道类型;
③同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)NaH具有NaCl型晶体结构,食盐晶体里Na+和Cl-的间距为棱长的一半,其密度=$\frac{m}{V}$.
解答 解:(1)①Cl原子核外有17个电子,其3s、3p能级电子为其价电子,则其价电子排布式为3s23p5,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,
故答案为:3s23p5;9;
②LiBH4由Li+和BH4-构成,BH4-中B原子价层电子对个数是4且不含孤电子对,所以空间构型是正四面体,B原子的杂化轨道类型是sp3,故答案为:正四面体;sp3;
③同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能B>Li,故答案为:B>Li;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Li+<H-,故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,故答案为:Mg;
(3)NaH具有NaCl型晶体结构,NaH晶体的晶胞参数a=480pm(棱长),Na+半径为104pm,H-的半径为$\frac{480-104×2}{2}$=136pm,该晶胞中钠离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氢离子个数=12×$\frac{1}{4}$+1=4,NaH的理论密度是ρ=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{24×4}{(480×1{0}^{-10})^{3}{N}_{A}}$g•cm-3=$\frac{96}{(4.8×1{0}^{-8})^{3}{N}_{A}}$g•cm-3,
故答案为:136;$\frac{96}{(4.8×1{0}^{-8})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断等知识点,侧重考查学生分析判断及计算能力,难点是晶胞计算,需要学生具有丰富的空间想象能力.


科目:高中化学 来源: 题型:选择题
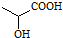 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

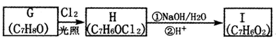
 .
. .
.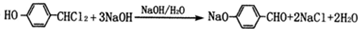 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
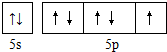 .
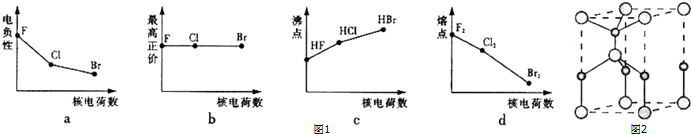
.
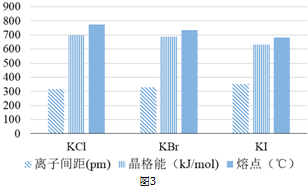
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
己知:60℃ 时,KNO3的溶解度为110g。在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到
A.悬浊液 B.饱和溶液
C.质量分数约为50%的溶液 D.物质的量浓度为10mol/L的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com