
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A、由Q与Y形成的化合物中只存在离子键 |
| B、Z与X之间形成的化合物具有还原性 |
| C、由X、Y、Z三种元素形成的化合物,一定是共价分子 |
| D、Y与W形成的化合物中,Y显负价 |


科目:高中化学 来源: 题型:
| A、分液、过滤、萃取、蒸馏 |
| B、萃取、结晶、蒸馏、分液 |
| C、蒸馏、萃取、分液、结晶 |
| D、分液、结晶、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
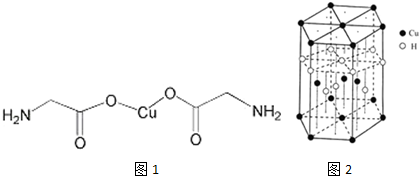
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙呈红色的溶液中:K+、AlO2-、NO3-、CO32- | ||
| B、c(ClO-)=1.0 mol?L-1溶液:Na+、SO32-、S2-、Cl- | ||
| C、水电离出来的c(H+)=1×10-12的溶液:K+、NH4+、SO42-、Fe3+ | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
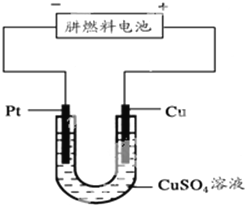 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-,Ca2+,OH-,Cl- |
| B、H+,Na+,SO42-,Cl- |
| C、H+,SO32-,K+,SO42- |
| D、H+,Cl-,Ag+,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
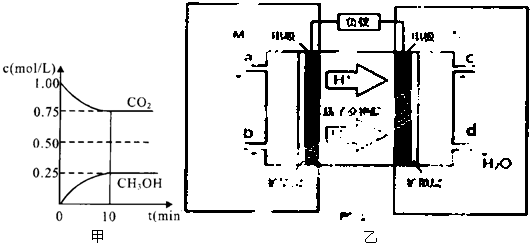
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com