
【题目】含Na2SO4、NaCl、MgCl2的1L混合溶液c (Na+) = 0.5 mol/L,c(Cl-)=0.4 mol/L,c(Mg2+)= 0.15 mol/L则此溶液中c (SO42-)为
A.0.15 mol/LB.0.2 mol/L
C.0.3 mol/LD.0.4 mol/L
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍 (Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
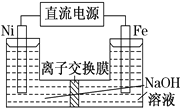
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2↓
B. 电解一段时间后,镍电极附近溶液的pH减小
C. 每制得1 mol Na2FeO4,理论上可以产生67.2L气体
D. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
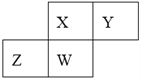
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理工业酸性废水中NO3-的电解池工作原理如图所示,电解总反应为4NO3-+4H+![]() 2N2↑+5O2↑+2H2O。下列说法正确的是
2N2↑+5O2↑+2H2O。下列说法正确的是

A. X电极上发生还原反应
B. Y电极上发生的电极反应为2NO3-+10e-+12H+==N2↑+6H2O
C. 电解池工作时,H+从质子交换膜右侧向左侧移动
D. 电解池工作时,电路中每通过2mol电子,生成15.68L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人的纯净胃液是一种无色而呈酸性的液体,pH在0.9~1.5之间,胃液中含有大量盐酸,其中的H+浓度比血液高几百万倍,试回答下列问题:
①若胃液酸度增高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药物的主要成分的是(____)
A.小苏打粉 B.氢氧化铝粉 C.氧化钙粉 D.纯碳酸钙粉
②胃溃疡患者胃酸过多可考虑选用①中的 ________________。(填字母编号)写出反应的化学方程式______________________________ 。
(2)现有下列四种物质:A.食盐B.食醋 C.苹果汁 D.葡萄糖,请按下列要求填空(填序号)。
富含维生素C的是_________;可直接进入血液补充能量的是_________;即可作为调味剂,又可预防感冒的是_________;食用过多会引起血压升高、肾脏受损的________。
(3)保护环境、呵护地球已成为为类共同的呼声。
①水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是__________(填字母编号);
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃。根据垃圾分类方法,矿泉水瓶属于__________(填“可回收物”或“可堆肥垃圾”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3 . ①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式 . 已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH= .
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式 .
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是 . A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收.吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示: 
①图中pH=7时,溶液中离子浓度关系正确的是 .
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣ )+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣ )>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3=2H++SO32﹣的平衡常数的数值 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,并回答下列问题: 
(1)判断装置的名称:A池为 .
(2)锌电极反应式为 , 石墨棒C1为极,电极反应式为 , 石墨棒C2附近发生的实验现象为 .
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了g.CuSO4溶液的质量增加了g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学选修3:物质结构与性质】
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(l)基态Cr原子的电子排布式为____;Fe位于元素周期表的___ 区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为____,其中四种元素第一电离能由小到大的顺序是____。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?____。
(4)在硅酸盐中存在![]() 结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)
结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)![]() 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个![]() 形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
若其中有一半的Si被Al替换,其化学式为____。

(5) Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为____,若Ca与O的核间距离为x nm,则该晶体的密度为___ g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com