
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
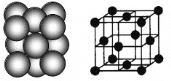
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
【答案】(1)第四周期ⅠB族(1分) 1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(1分)
(2)①N>O>C(1分)
②ACE(2分)
③sp2(2分) 平面正三角形(2分) O3(2分)
(3)12(2分) 74%(2分)
【解析】(1)铜元素在周期表中的位置是第四周期ⅠB族。基态铜原子的电子排布式是1s22s22p63s23p63d104s1或写成[Ar]3d104s1。
(2)①同周期元素的第一电离能总体上随着原子序数的增大而增大,但是N的最外层电子排布是2s22p3,p轨道半充满较稳定,因此第一电离能比O大,所以C、N、O三种元素的第一电离能从大到小的顺序为N>O>C。②Ag+和NH3间是配位键,[Ag(NH3)2]+和OH间是离子键,NH3内部是极性键。故选ACE。③![]() 的孤电子对数为0,价电子对数为3,成键电子对数为3,故空间构型为平面正三角形,中心原子杂化轨道类型为sp2。与
的孤电子对数为0,价电子对数为3,成键电子对数为3,故空间构型为平面正三角形,中心原子杂化轨道类型为sp2。与![]() 、SO2互为等电子体的短周期元素单质分子是O3。
、SO2互为等电子体的短周期元素单质分子是O3。
(3)面心立方最密堆积的配位数为12。设银原子的直径为d,每个银晶胞含4个银原子,则:空间利用率=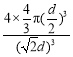 ×100%=74%。
×100%=74%。


科目:高中化学 来源: 题型:
【题目】X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子总数比Y原子核外电子总数少5个,则X、Y可形成的化合物是
A. 离子化合物Y(XO4)2 B. 离子化合物Y2X3
C. 共价化合物XY2 D. 离子化合物Y3X2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表含元素最多的族是第ⅢB族
B. 元素周期表有18个族
C. 第1 A族的元素全部是金属元素
D. 短周期是指第一、二、三、四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在50 mL 0.1 mol·L1的NaOH溶液中逐滴加入0.2 mol·L1的醋酸,溶液pH随所加醋酸的体积变化曲线如图。下列说法正确的是

A.在A、B之间任意一点都满足:c(Na+)>c(CH3COO)>c(OH)>c(H+)
B.在B点,a>25,且c(Na+)=c(CH3COO)=c(OH)=c(H+)
C.在C点:c(Na+)>c(CH3COO)>c(H+)>c(OH)
D.在D点:c(OH) +c(Na+)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A. m、n B. 3、7 C. m-2、10-n D. m+2、n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一个反应表示二氧化硫被还原 ( )
A. SO2+2H2O+Cl2===H2SO4+2HCl B. SO2+2H2S===2H2O+3S
C. SO2+2NaOH===Na2SO3+H2O D. SO2+Na2CO3===Na2SO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对外加电流的保护法中,下列叙述正确的是
A.电子从被保护金属流向电源的负极
B.被保护的金属与电源的负极相连
C.在被保护的金属表面上发生氧化反应
D.被保护的金属表面上不发生氧化反应,也不发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com