
【题目】下列说法不正确的是
A. 钠和钾的合金可用于快中子反应堆作热交换剂
B. 可用超纯硅制造的单晶硅来制芯片
C. 可利用二氧化碳制造全降解塑料
D. 氯气有毒,不能用于药物的合成
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
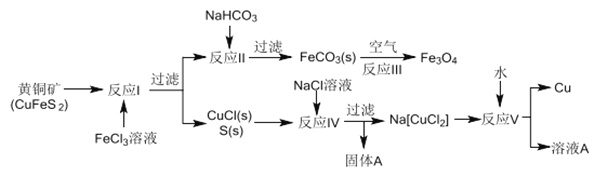
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。
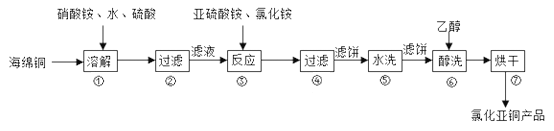
回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
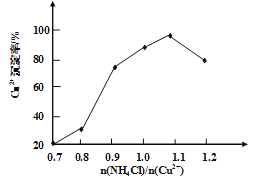
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比![]() 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
A.K+、H+、Fe2+、MnO4﹣
B.Fe3+、Ba2+、SO42﹣、NO3﹣
C.Al3+、Na+、SO42﹣、CO32﹣
D.Fe3+、H+、SO42﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3++Fe3+。下列说法正确的是( )
A. Ce元素位于元素周期表第六周期第IIIB族
B. ![]() 、
、![]() 是同素异形体
是同素异形体
C. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D. 铈的原子核外有58个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有句谚语“每天一个苹果,医生远离我”。说明苹果是一种对人体健康非常有益的水果,苹果为人体提供的主要营养素是( )
A. 油脂 B. 无机盐
C. 蛋白质 D. 维生素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,②H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是
A. 氢氟酸的电离方程式及热效应可表示为: HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是( )
A.20Ne和22Ne互为同位素
B.20Ne和22Ne互为同分异构体
C.20Ne和22Ne的质量数相同
D.20Ne和22Ne的中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
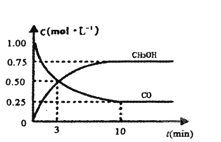
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
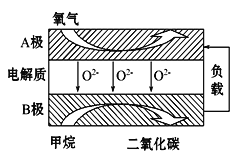
1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com