
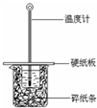
 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示. | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.3 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.0 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.6 | |
| Q |
| n |
| 3.2℃+3.1℃+3.3℃ |
| 3 |
| 1.3376KJ |
| 0.025mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
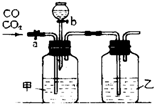 某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.
某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2 和(NH4)2SO4 |
| B、(NH4)2SO4 和(NH4)2CO3 |
| C、NaOH和CaCl2 |
| D、NaOH和(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾[KAl(SO4)2?12H2O]溶解在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、玻璃具有耐腐蚀性,可以用玻璃试剂瓶长期保存酸、碱溶液 |
| C、浓H2SO4有强氧化性,但常温下可以用铁槽车运输 |
| D、将SO2通入溴水,溴水褪色后加热能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
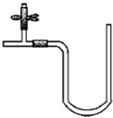 “阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 | 若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com