


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
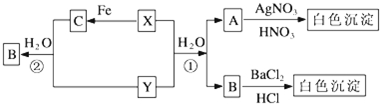
科目:高中化学 来源: 题型:
 在如图所示的装置中进行中和反应的反应热测定,实验操作如下:
在如图所示的装置中进行中和反应的反应热测定,实验操作如下:| 起始温度T1/(℃) | 终止温度T2/(℃) | 温度差 T2-T1 /(℃) | |||
| HCl | NaOH | 平均值 | |||
| 1 | 20.5 | 20.7 | 24.1 | ||
| 2 | 20.4 | 20.6 | 23.8 | ||
| 3 | 20.6 | 20.4 | 23.9 | ||
| 平 均 值 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
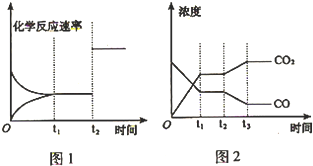
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO | |||
| 1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
| 2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
| 3 | 900℃ | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| B、用二氧化硫水溶液吸收溴蒸气:SO2+Br2+2H2O=2H++SO42-+2HBr | ||
| C、在(NH4)2SO4溶液中逐滴加入少量的Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3?H2O | ||
| D、次氯酸钙溶液中通入少量SO2气体:Ba2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、在1L 0.1mol?L-1碳酸钠溶液中阴离子总数小于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com