
| A. | CH3CH═CH2与HCl加成 | |
| B. | CH3CH2CH2Cl在碱性溶液中水解 | |
| C. | CH2═CH-CH═CH2与H2按物质的量之比为1﹕1进行反应 | |
| D. | 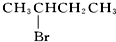 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
分析 根据同分异构体是分子式相同,但结构不同的化合物.
A、CH3-CH=CH2不是对称结构,与氯化氢发生加成反应,氯原子可以连接在中间碳原子上,也可以连接在不饱和的端碳原子上;
B、CH3CH2CH2Cl与NaOH水溶液共热发生取代反应,-OH取代Br原子,生成CH3CH2CH2OH;
C、CH2=CH-CH=CH2与H2按物质的量之比1:1加成,可能发生1,2-加成,也可能出1,4-加成;
D、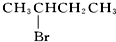 不是对称结构,与溴原子相连碳相邻碳原子上有2种化学环境不同的氢原子,发生消去反应有2种产物.
不是对称结构,与溴原子相连碳相邻碳原子上有2种化学环境不同的氢原子,发生消去反应有2种产物.
解答 解:A、CH3-CH=CH2一定条件下与HCl加成,可以生成1-氯丙烷,也可以生成2-氯丙烷,存在同分异构体,故A不符合;
B、CH3CH2CH2Br与NaOH水溶液共热发生取代反应,-OH取代Br原子,生成CH3CH2CH2OH,不存在同分异构体,故B符合;
C、CH2=CH-CH=CH2与H2按物质的量之比1:1加成,生成1-丁烯或1,3-丁二烯,存在同分异构体,故C不符合;
D、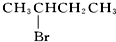 在氢氧化钠醇溶液存在下,发生分子内脱水,生成1-丁烯或2-丁烯,存在同分异构体,故D不符合.
在氢氧化钠醇溶液存在下,发生分子内脱水,生成1-丁烯或2-丁烯,存在同分异构体,故D不符合.
故选B.
点评 本题以加成反应与消去反应为载体,考查同分异构体、常见有机物的性质等,掌握加成反应与消去反应的反应原理是解题的原理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.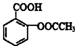 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为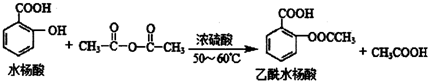
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2+2H2O+4e-=4OH- | B. | Fe-3e-=Fe3+ | ||
| C. | Fe-2e-=Fe2+ | D. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | NaNO3 | C. | Mg(NO3)2 | D. | Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com