
【题目】如图A是某粒子的结构示意图,B是铝元素在周期表中的信息。

(1)若A粒子带有两个单位的负电荷,且y等于8,则该粒子的符号为___。
(2)当x=17时,A元素和B元素形成的化合物的化学式为___。
(3)B元素的单质在空气中能生成致密的___(化学式)薄膜。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有某些相似的结构和性质。下列各组粒子中等电子体的是____(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43-和SO42-
【答案】S2- AlCl3 Al2O3 BD
【解析】
(1)根据粒子中核内质子数和核外电子数之间的关系解答;
(2)根据结构示意图及化学式的写法解答;
(3)根据B是铝元素,B元素的单质在空气中能生成致密的氧化铝薄膜解答;
(4)根据等电子体在计算时,是将组成的各原子的电子数相加所得的和解答。
(1)若A粒子带有两个单位的负电荷,且y 等于8,说明得到两个电子,则x=2+8+6=16,该粒子为硫离子,符号为S2,故答案为:S2-;
(2)当x=17时,A元素是氯元素,与金属形成化合物时显1价,B是铝元素,化合价是+3价,化合物的化学式为AlCl3,故答案为:AlCl3;
(3)B是铝元素,B元素的单质在空气中能生成致密的氧化铝薄膜,化学式为:Al2O3;
(4)A. NO的质子数为7+8=15,O2的质子数为8×2=16,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体,A项错误;
B. CO的质子数为6+8=14,N2的质子数为7×2=14,分子中质子数等于电子数,且两者的分子中含有的原子个数都是2,所以两者是等电子体,B项正确;
C. SO2的质子数为16+8×2=32, CO2的质子数为6+8×2=22,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体,C项错误;
D. 一个PO43离子中有5个原子,有15+8×4+3=50个电子,一个SO42-离子中有5个原子,有16+8×4+2=50个电子,所以这两种离子是等电子体,D项正确;
故答案为:BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)氧化剂_____,还原剂_____;
(2)反应中转移电子数是_____;
(3)氧化剂与氧化产物的质量比_____;
(4)当生成2.8gN2时,被氧化的物质的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL pH =1的CH3COOH 溶液加水稀释至100 mL后,溶液的pH为
A. 2 B. 2<pH<7 C. 1<pH<2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
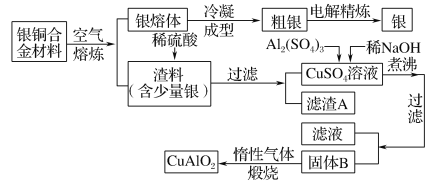
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中错误的是( )
A. 加入含有NaOH的酚酞溶液,红色褪去,说明有H+存在
B. 加入有色布条后,有色布条退色,说明有HClO分子存在
C. 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂( LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、 LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:

已知:Ksp(Li2CO3)=1.6×10-3。部分物质的溶解度(S)如下表所示:

(1)写出碱溶时Al箔溶解的离子方程式:______________________。
(2)为提高酸浸的浸出率,除粉碎、挑拌、升温外,还可采用的方法有_________________________________。
(3)酸浸时产生标况下3.36LNO时,溶解 LiFePO4_________mol(其他杂质不与HNO3反应)。
(4)若滤液②中c(Li+)=4mol·L-1,加入等体积的Na2CO3后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=___________mol/L。
(5)流程中用“热水洗涤”的原因是____________________________________________。
(6)工业上将回收的Li2CO3、FePO4粉碎与炭黑混合高温灼烧再生制备 LiFePO4,写出反应的化学方程式:_________________________________;若测得产品中n(Li)︰n(Fe)︰n(P)=1︰0.9︰1,则产品中n(Fe2+)/n(Fe3+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置为某实验小组设计的 Cu-Zn 原电池,关于其说法错误的是

A. 装置甲中电子流动方向为:Zn→电流表→Cu
B. 装置乙比装置甲提供的电流更稳定
C. 装置乙盐桥中可用装有琼胶的 Na2CO3饱和溶液
D. 若装置乙中盐桥用铁丝替代,反应原理发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaF2)=4×10-9,Ksp(CaSO4)=9.1×10-6。取一定量的CaF2固体溶于水,溶液中离子浓度的变化与时间的变化关系如图所示。下列有关说法正确的是

A. M点表示CaF2的不饱和溶液
B. 常温下,CaF2的饱和溶液中,c(F-)=10-3mol/L
C. 温度不变,t时刻改变的条件可能是向溶液中加了KF固体,CaF2的Ksp增大
D. 常温下,向100 mL CaF2的饱和溶液中加人10mL0.2mol/LNa2SO4溶液,平衡后溶液中的c(Ca2+)约为9.1×10-4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C2H4及C2H2等均可用适当的羧酸盐采用Kolbe电解法得到。如图为制取C2H2的电解装置,该装置工作时,下列说法中错误的是

A. 电能转变为化学能
B. 阴极周围溶液的pH不断升高
C. 电极a上发生:![]()
D. 制取乙烯可用CH3COOK溶液作阳极电解液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com