

| A. | EGG的分子式为C15H12O7 | |
| B. | EGG可在NaOH的醇溶液中发生消去反应 | |
| C. | 1molEGG最多消耗5molNaOH | |
| D. | 1molEGG可与2molBr2发生取代反应 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有醇羟基,可发生取代、消去和氧化反应,结合苯的性质解答该题.
解答 解:A.由结构简式可知EGG的分子式为C15H14O7,故A错误;
B.不含卤素原子,在NaOH的醇溶液中不能发生消去反应,故B错误;
C.只有酚羟基与氢氧化钠发生反应,则1molEGG最多消耗5molNaOH,故C正确;
D.酚羟基邻位、对位可发生取代反应,则1molEGG可与4molBr2发生取代反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚、醇的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4和NH4+是等电子体,键角均为60° | |
| B. | B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形结构 | |
| D. | NO3-和CO32-是等电子体,均为平面正三角形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
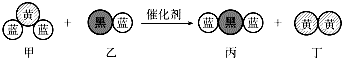
| A. | 若蓝、黑球原子的相对质量之比为4:3,则乙、丙两物质的摩尔质量之比为7:11 | |
| B. | 若乙丙中蓝球元素显相同负价,则乙中黑球元素失去电子,被氧化 | |
| C. | 若甲中黄球元素显正价,则丁为还原产物 | |
| D. | 化学方程式中乙、丁的化学计量数均为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期在含有高浓度的二氧化硅粉尘的环境中工作,易患矽肺病 | |
| B. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于传统无机非金属材料 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 只用米汤就能检验出食盐中是否有碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L水的质量为1.8g | |
| B. | 常温常压下,32gO3含有的原子数为2NA | |
| C. | 11.2L的N2含有的质子数为7NA | |
| D. | 0.1molNa投入到5mL水中转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 | H2O2 | O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
| A. | 表中①反应的氧化产物只能有FeCl3 | |
| B. | 表中②生成1mol的O2将有4mol的电子转移 | |
| C. | 还原性比较:H2O2>Mn2+>Cl- | |
| D. | 表中④的离子方程式配平后,H+的化学计量数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 储氢合金是利用金属或合金与氢形成氢化物而把氢储存起来.MgH2,LaNi5,MmNiMnK(Mm代表混合稀土)等是几类常见的储氢材料.近期,最新研究发现,在镍的表面覆盖石墨烯(如图所示),可以大大增加储氢材料释放氢气的速率.已知:石墨烯是一种有单层碳原子组成的平面结构,具有良好的导电、导热性.回答下列问题:
储氢合金是利用金属或合金与氢形成氢化物而把氢储存起来.MgH2,LaNi5,MmNiMnK(Mm代表混合稀土)等是几类常见的储氢材料.近期,最新研究发现,在镍的表面覆盖石墨烯(如图所示),可以大大增加储氢材料释放氢气的速率.已知:石墨烯是一种有单层碳原子组成的平面结构,具有良好的导电、导热性.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com