
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
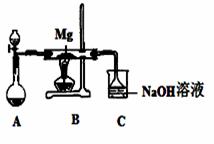
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可改进,改进的方法是
,
若C中NaOH为0.2mol/L、200ml,通入的SO2为1.12L(标准状况),则该反应的离子方程式为
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2 2MgSO3+S;
2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS,
2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选。请填写下表中的空格:
根据上述实验探究:
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后的固体于试管I中 |
|
| ② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 的试管II中。 | 若试管I中的 , 则丙同学推测正确。若试管I中的固体未完全溶解,且 ,则乙同学的推测正确。 |
【知识点】化学实验、元素化合物J4 B1D3 C2
【答案解析】(1)②③(2分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分);OH—+SO2=HSO3—(2分)
(3)2Mg+SO2  2MgO+S;(1分)
2MgO+S;(1分)
2mol/L盐酸 固体完全溶解
品红溶液 品红溶液褪色 (每空1分)
解析:(1)制取二氧化硫用浓H2SO4、Na2SO3固体,不能选择亚硫酸钙,因为亚硫酸钙、硫酸钙都微溶于水,也不能选择浓盐酸,因为盐酸具有挥发性,产生的HCl、水蒸气对镁与二氧化硫的反应产物产生干扰;
(2)水蒸气对镁与二氧化硫的反应产物产生干扰,因此上述装置缺少干燥装置,应该在A和B之间增加用浓硫酸干燥的装置;NaOH为0.04mol,SO2为0.05mol,二者反应二氧化硫过量,则生成物是亚硫酸氢钠,离子反应为OH—+SO2=HSO3—
(3)由于CO2+2Mg 2MgO+C,则2Mg+SO2
2MgO+C,则2Mg+SO2 2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸;氧化镁难溶于水,可溶于酸;亚硫酸镁微溶于水,易溶于盐酸,反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案,即固体全溶于盐酸的,则丙正确;固体不全溶于盐酸的,生成的气体使品红溶液褪色,则乙正确;固体不全溶于盐酸的,没有气体生成的,则甲正确。
2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸;氧化镁难溶于水,可溶于酸;亚硫酸镁微溶于水,易溶于盐酸,反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案,即固体全溶于盐酸的,则丙正确;固体不全溶于盐酸的,生成的气体使品红溶液褪色,则乙正确;固体不全溶于盐酸的,没有气体生成的,则甲正确。
【思路点拨】假设的验证是根据物质的性质确定方案,而在设计实验使要防止干扰及设计需严密,如本题就是依据物质的性质设计实验;不能选用硝酸,因为硝酸与MgSO3、MgS
都发生氧化还原反应,现象相同。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
下列关于乙醇的性质及用途的叙述中,正确的是( )
|
| A. | 能与水任意比例互溶 |
|
| B. | 可溶解多种有机物 |
|
| C. | 可令酸性高锰酸钾溶液褪色 |
|
| D. | 药用酒精在医疗上用作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
日常所用干电池的电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:
Zn-2e-—→Zn2+,2NH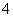 +2e-—→2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论不正确的是( )
+2e-—→2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论不正确的是( )
A.Zn为正极,碳为负极
B.Zn为负极,碳为正极
C.工作时,电子由Zn极经过导线流向碳极
D.长时间连续使用时,内装糊状物可能流出腐蚀用电器
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理不同
B.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂排放的SO2烟气对环境造成污染,某企业用下列流程综合处理,下列有关说法正确的是( )
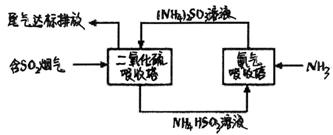
A.二氧化硫吸收塔中发生的反应为:SO2+ SO32-+H2O=2HSO3-
B.氨气吸收塔中发生的反应为:HSO3-+OH-= H2O+ SO32-
C.上述流程利用的是氧化还原反应原理
D.上述流程可循环利用的物质有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
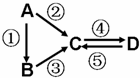
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:______________________________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:__________________________________。
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:__________________________。
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质. B与C可反应生成A。请写出B的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.水溶液X中只可能溶有K+、Mg2+、Al3+、AlO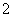 、SiO
、SiO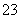 、SO
、SO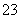 、CO
、CO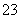 、SO
、SO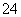 中的若干种离子。某同学对该溶液进行了如图实验:
中的若干种离子。某同学对该溶液进行了如图实验:
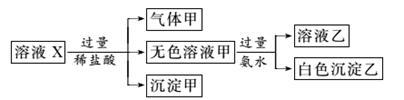
下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO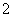 和SiO
和SiO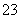 一定存在于溶液X中
一定存在于溶液X中
D.CO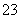 和SO
和SO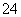 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,a、b、c分别为三种氢化物,
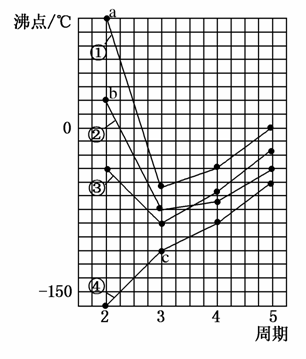
(1)其中表示ⅥA元素气态氢化物沸点的是曲线________(填标号,下一空同),表示ⅣA族元素气态氢化物沸点的是曲线________。
(2)a的电子式为________,b的空间构型为________,c的化学式为________。
(3)同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是________________。曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com