
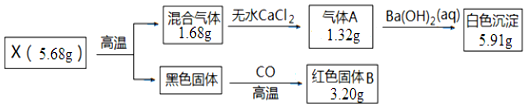
 化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:
化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:分析 (1)根据在化合物中正负化合价代数和为零进行分析解答;NaN3(叠氮酸钠)中阴离子的符号为N3-;
(2)NaN3受撞击分解产生金属钠和氮气,反应方程式为2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;金属钠将Fe2O3中铁置换出来,同时又将KClO4还原为KCl,反应方程式为Fe2O3+6Na $\frac{\underline{\;撞击\;}}{\;}$2Fe+3Na2O,KClO4+8Na $\frac{\underline{\;撞击\;}}{\;}$KCl+4Na2O;NaHCO3不稳定,受热易分解,生成稳定的Na2CO3、H2O、CO2,反应方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,据此分析解答;
(3)根据反应方程式依次为2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑,Fe2O3+6Na $\frac{\underline{\;撞击\;}}{\;}$2Fe+3Na2O,KClO4+8Na $\frac{\underline{\;撞击\;}}{\;}$KCl+4Na2O分析;
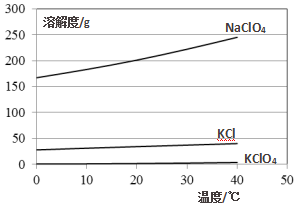
(4)由溶解度图可知,NaClO4溶解度较大,KClO4溶解度较小,从溶液中制取KClO4,称取一定质量的KCl、NaClO4溶解后加热反应、再冷却结晶,过滤,蒸馏水洗涤干净,真空干燥得到KClO4.
解答 解:(1)根据在化合物中正负化合价代数和为零,可得高氯酸钾中氯元素的化合价为:(+1)+x+(-2)×4=0,解答 x=+7;NaN3(叠氮酸钠)中阴离子的符号为N3-;故答案为:+7;N3-;
(2)①根据以上分析,气药剂反应生成的混合气体为CO2、N2、H2O,故答案为:CO2、N2、H2O;
②根据以上分析,固体产物中有Na2O、Na2CO3,故答案为:Na2O、Na2CO3;
③气药剂反应生成的混合气体为H2O、CO2、N2,碱石灰恰好能吸收水和二氧化碳,所以若气体通过足量的碱石灰后体积为33.6L(标准状况)即N2,物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,化学反应过程中遵守氮原子守恒,可知NaN3的物质的量为$\frac{1.5mol×2}{3}$=1mol,NaN3的质量为1mol×65g/mol=65g,气药剂中NaN3的质量分数为$\frac{65g}{100g}$×100%=65%,故答案为:65%;
(3)由以上分析,反应方程式依次为2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑,Fe2O3+6Na $\frac{\underline{\;撞击\;}}{\;}$2Fe+3Na2O,KClO4+8Na $\frac{\underline{\;撞击\;}}{\;}$KCl+4Na2O,所以欲使各物质均反应完全,则有n( NaN3)=6n(Fe2O3)+8n(KClO4),故答案为:n( NaN3)=6n(Fe2O3)+8n(KClO4);
(4)由溶解度图可知,NaClO4溶解度较大,KClO4溶解度较小,从溶液中制取KClO4,称取一定质量的KCl、NaClO4溶解后加热反应、再冷却结晶,过滤,蒸馏水洗涤干净,真空干燥得到KClO4,故答案为:冷却结晶,过滤.
点评 本题以汽车安全气囊的产气药剂为载体,考查化学反应方程式的书写、化合价的计算以及物质的量与质量、气体摩尔体积之间的计算,原子守恒等,属于拼合型题目,侧重对基础知识的考查,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO4溶液与BaCl2溶液反应 | |
| B. | CO和水蒸气在一定条件下反应生成CO2和H2 | |
| C. | 将Na2CO3加人石灰水中 | |
| D. | Na2O溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑤③ | B. | ⑥③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广和鼓励多使用公共交通工具出行 | |
| B. | 秸秆就地焚烧,降低运输成本 | |
| C. | 大力发展太阳能和风力发电 | |
| D. | 对燃煤进行脱硫,减少SO2对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的钠保存在煤油中 | |
| B. | 氢氟酸保存在玻璃瓶中 | |
| C. | 新制的氯水保存在棕色玻璃瓶中 | |
| D. | NaOH溶液保存在带橡皮塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
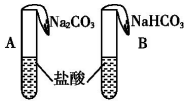 某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )
某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )| A. | 起初A气球鼓胀速度快,最终B气球大 | |
| B. | 起初B气球鼓胀速度快,最终两气球一样大 | |
| C. | 最终两溶液中氯离子物质的量浓度相同 | |
| D. | 最终两溶液中钠离子物质的量浓度不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com