
| A. | 氢氧化钠的摩尔质量为40g | |
| B. | 1摩尔氧原子的质量就是氧的相对原子质量 | |
| C. | H2SO4的摩尔质量为96g•mol-1 | |
| D. | 1molCO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |
分析 A、摩尔质量的单位为g/mol;
B、质量的单位为g;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量;
D、1mol二氧化碳的质量为44g.
解答 解:A、摩尔质量的单位为g/mol,故氢氧化钠的摩尔质量为40g/mol,故A错误;
B、质量的单位为g,故1molO原子的质量为16g,而其相对原子质量为16,只是数值上相等,故B错误;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量,硫酸的相对分子质量为98,故其摩尔质量为98g/mol,故C错误;
D、1mol二氧化碳的质量为44g,而二氧化碳的相对分子质量为44,故两者在数值上相等,故D正确.
故选D.
点评 本题考查了摩尔质量的数值和单位,应注意的是一种物质的摩尔质量在数值上等于该物质的相对分子质量.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
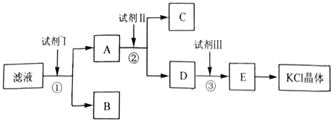
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 K2SO4溶液中含有0.6NA个K+和0.3 mol的SO42- | |
| B. | 在标准状况下H2O的摩尔体积约是22.4 L•mol-1 | |
| C. | 将58.5g的NaCl固体溶解在1L的水中,所得的溶液物质的量浓度为1mol/L | |
| D. | 1 mol任何气体在标准状况下的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
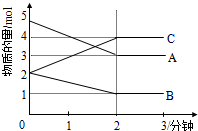 (1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
(1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com