
| 8.8g |
| 44g/mol |
| 5.4g |
| 18g/mol |
| 1.6g |
| 16g/mol |
| 4.6g |
| 46g/mol |
| 0.2mol |
| 0.1mol |
| 0.6mol |
| 0.1mol |
| 0.1mol |
| 0.1mol |
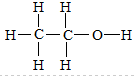 ;有可能为甲醚,结构式为:
;有可能为甲醚,结构式为: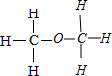 ,
,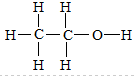 或
或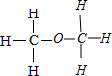 .
.


科目:高中化学 来源: 题型:
| A、升高温度 | B、降低温度 |
| C、增大压强 | D、减少压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、SO42-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验前 | 实验后 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com