
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
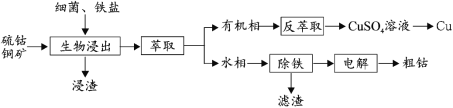
回答下列问题:
(1)Cu2+的生物浸出原理如下:
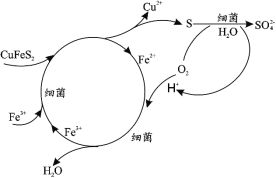
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
【答案】温度过高细菌失活 ![]() CaSO4、SiO2 H2SO4
CaSO4、SiO2 H2SO4 ![]() 铁氰化钾 阴 铜
铁氰化钾 阴 铜
【解析】
(1)温度过高细菌失活,浸出率急剧下降,根据Cu2+的生物浸出推断Co2+的生物浸出;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4沉淀,SiO2不参与反应,金属阳离子进入滤液;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸;
(4)H2O2和Fe2+反应生成FeOOH沉淀,根据电荷守恒和原子守恒配平方程;亚铁离子遇到铁氰化钾会生成深蓝色的沉淀,故检验亚铁离子可选用铁氰化钾溶液;
(5)电解精炼时粗钴为阳极,放电顺序为Fe>Co>Cu,精钴为阴极电解质为CoSO4,以此分析。
(1)温度过高细菌失活,浸出率急剧下降;根据Cu2+的生物浸出可知矿物再细菌和Fe3+作用下化合物中S元素转化为S单质,则Co2+的生物浸出离子方程式为:![]() ,故答案为 :温度过高细菌失活;
,故答案为 :温度过高细菌失活;![]() ;
;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4,SiO2不参与反应,金属阳离子进入滤液,则浸出渣的主要成分为CaSO4、SiO2,故答案为:CaSO4、SiO2;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸,故答案为:H2SO4;
(4)H2O2和Fe2+反应生成FeOOH沉淀,离子方程式为![]() 。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:
。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:![]() ;铁氰化钾;
;铁氰化钾;
(5)电解精炼时粗钴为阳极,精钴做阴极。电解精炼时,Fe和Co溶解,Cu较不活泼,不能溶解,因此,阳极泥主要为铜,故答案为:阴;铜。


科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置模拟石灰石燃煤烟气脱硫实验:

(1)实验中为提高石灰石浆液脱硫效率采取的措施是____,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式____。
(2)将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是____。
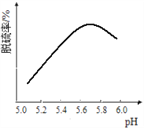
(3)研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是____,烟气通入石灰石浆液时的温度不宜过高,是因为____。
(4)石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3,实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,____。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如图所示,有关其性质叙述不正确的是( )
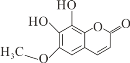
A.该有机物分子式为C10H8O5
B.分子中有四种官能团
C.该有机物能发生加成、氧化、取代等反应
D.1mol该化合物最多能与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是空气中主要的大气污染物,国家规定在排放前必须经过处理。
Ⅰ.碱液吸收法:工业上常用NaOH溶液做吸收液。
(1)向0.5L1 mol·L-1的NaOH溶液中通入标准状态下11.2L的SO2。
①写出反应的离子方程式__________;
②已知:Ka1=1.54×10-2,Ka2=1.02×10-7,则所得溶液呈_______(填“酸性”、“碱性”或“中性”),下列有关吸收液中粒子浓度大小关系正确的是_________。
A c(H2SO3)>c(SO32-)
B c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
C c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)
D c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
(2)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收SO2后所得溶液以实现吸收液的回收再利用,装置如下图所示:
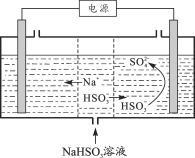
①工作一段时间后,阴极区溶液的pH_______(填“增大”、“减小”或“不变”)。
②写出阳极的电极反应式_______。
Ⅱ.SO2的回收利用:
(3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)![]() SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
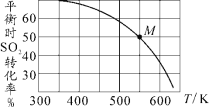
① 该反应的ΔH________(填“>”、“<”或“=”)0。
② 若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=_____(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2molL﹣1的氯化铁溶液中,充分反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色,Cl﹣浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. Fe2+和Fe3+的物质的量之比为6:1
D. 氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL2.0 mol/L 碳酸钠溶液和 200mL 盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.0.9 mol/LB.1.5mol/LC.2.0 mol/LD.2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列过程的方程式:
(1)小苏打溶于水的电离方程式___。
(2)碳酸钠溶液呈碱性,用离子方程式表示其原因___。
(3)FeCl3 溶液使湿润的淀粉碘化钾试纸变蓝色,写出离子方程式___。
(4)将等物质的量的 NH4HSO4 和 Ba (OH)2 溶液混和的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com