
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两只试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(选填“>”、“<”或“=”);乙方案中,说明HA是弱电解质的现象是_______。
a.装HCl 溶液的试管中放出H2的速率快
溶液的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两只试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处或不妥之处_________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:___________________________________________________________________。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
在标准状况下,①6.72 L CH4气体 ②3.01×1023个HCl气体分子 ③13.6 g H2S气体 ④0.2 mol NH3,按下列要求对这四种气体的关系从大到小进行排列(用上述数字序号表示):
(1)标准状况下四种气体的体积 .
(2)四种气体的质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
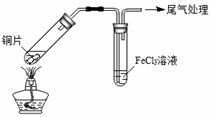
A B
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是 。写出装置A中产生SO2的化学方程式: 。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因: 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为 。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在NH3•H2O NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体
C.加少量氯化铵固体 D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A+B(s) C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是
A.正反应为放热反应 B.正反应为吸热反应
C.A为气体,C 为固体 D.A为固体,C为气体
为固体 D.A为固体,C为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 0.1 mol•L-1的氨水含有0.1NA个OH-
B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
C.25 ℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有物质的量浓度均为0.1 mol·L-1 的① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25 mL,,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4- +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中
c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42 -)≥ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 (填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量 g/mL(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com