
| A. | 石油裂解为乙烯属于取代反应 | |
| B. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| C. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| D. | C4H10进行一氯取代后生成四种沸点不同的产物 |
分析 A.石油裂解由C-C键生成C=C键;
B.乙酸与溴水不反应;
C.蛋白质水解生成氨基酸;
D.判断丁烷的同分异构体,再根据等效氢确定一氯代物的同分异构体.
解答 解:A.石油裂解由C-C键生成C=C键,不是取代反应,故A错误;
B.乙酸中羧基与溴水不发生氧化反应,则溴水不褪色,故B错误;
C.蛋白质水解生成氨基酸,不生成葡萄糖,故C错误;
D.丁烷有正丁烷与异丁烷两种同分异构体,正丁烷分子种有2种H原子,其一氯代物有2种,异丁烷分子种有2种H原子,其一氯代物有2种,故丁烷的一氯代物有4种,即有4种沸点不同的产物一氯代物,故D正确.
故选D.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的组成、结构和官能团的性质以及同分异构体的判断,难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 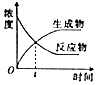 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 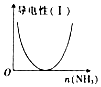 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 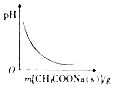 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用PH试纸测定氯水的PH | |
| B. | 用硫酸镁溶液除去氢氧化镁中的氢氧化钙 | |
| C. | 用KSCN溶液检验Fe2+的存在 | |
| D. | 液溴保存时通常要加少量水液封 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
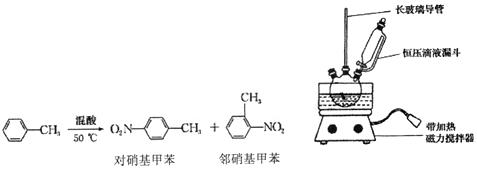
| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com