
1 g H2完全燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是
A.2H2 + O2 == 2H2O ΔH=-571.6kJ?mol-1
B.H2(g)+![]() O2(g)== H2O( l ) ΔH=-142.9 kJ?mol-1
O2(g)== H2O( l ) ΔH=-142.9 kJ?mol-1
C.H2(g)+![]() O2(g)== H2O ( l ) ΔH=-285.8 kJ?mol-1
O2(g)== H2O ( l ) ΔH=-285.8 kJ?mol-1
D.2H2(g)+O2(g)== 2H2O ( g ) ΔH=-571.6 kJ?mol-1
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为:
![]() N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 | 键能( kJ·mol-1) | 化学键 | 键能( kJ·mol-1) |
| N≡N | 942 | H—O | 460 |
| N—H | 391 | O==O | 499 |
| H—H | 437 |
①写出N2和H2反应合成氨的热化学方程式_________________________。
② 已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量___________________。H2O(g)的稳定性___________(“大于”“小于”)H2O(l)。
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2012届江西省抚州市教研室高二上学期期末考试化学试卷 题型:填空题
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
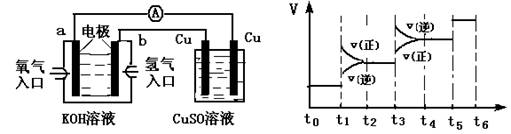
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,
2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com