
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池反应;
(3)如形成原电池反应,所加硫酸盐对应的金属应比锌的活泼性弱;
(4)结合浓度、温度、催化剂等因素对反应速率的影响分析;
(5)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4,
故答案为:Ag2SO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升高反应温度、适当增加硫酸的浓度;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml,所以V1=30ml,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为50ml,所以V9=50ml-30ml-2.5ml=17.5ml,
故答案为:30;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(5)小题,首先V1的求得要注意分析表中数据,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ⑤⑥ | C. | ③⑥ | D. | ①⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
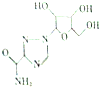 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
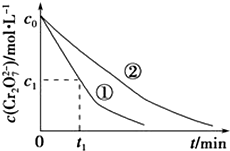 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
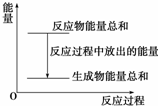 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com