
分析 (1)根据n=$\frac{m}{M}$计算56g铁的物质的量,再根据方程式计算SO2的物质的量,根据V=nVm计算SO2的体积;
(2)22.4L(标准状况)SO2气体物质的量为1mol,二氧化硫和水反应生成三氧化硫,SO2的转化率为50%,转化0.5mol,根据物质的量浓度c=$\frac{n}{V}$计算;
(3)SO2和H2 4.48L(标准状况)物质的量为0.2mol,向溶液中滴加KSCN 溶液溶液不变色,说明无铁离子,溶液中金属阳离子为亚铁离子,物质的量为0.2mol,根据铁原子、硫原子、得失电子守恒以及极限法解答.
解答 解:(1)56gFe的物质的量为n=$\frac{m}{M}$=$\frac{56g}{56g/mol}$=1mol,则:
2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O
2 3
1mol n(SO2)
所以n(SO2)=1.5mol,故V(SO2)=1.5mol×22.4L/mol=33.6L,
故答案为:33.6;
(2)22.4L(标准状况)SO2气体物质的量为1mol,二氧化硫和水反应SO2+H2O?H2SO3 ,SO2的转化率为50%,转化0.5mol,则所得溶液中H2SO3 的物质的量浓度为c=$\frac{n}{V}$=$\frac{0.5mol}{2L}$=0.25mol/L,
故答案为:0.25;
(3)在加热条件下,铁与浓硫酸发生反应的化学方程式为2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,铁与稀硫酸反应生成硫酸亚铁和氢气,即Fe+H2SO4=FeSO4+H2↑,Fe+Fe2(SO4)3=3FeSO4,SO2和H2 4.48L(标准状况)物质的量为0.2mol,向溶液中滴加KSCN 溶液溶液不变色,说明无铁离子,溶液中金属阳离子为亚铁离子,物质的量为0.2mol,溶液中最终含铁的溶质为硫酸亚铁,根据铁原子守恒:n(Fe)=n(FeSO4)=0.2mol,
Fe的化合价(0→+2)失去电子0.2mol×2=0.4mol,H2SO4中H的化合价(+1→0)生成1molH2,得到2mol电子,H2SO4中S的化合价(+6→+4)生成1molSO2,得到2mol电子,假设标准状况下物质的量为0.2mol全为SO2,消耗n(H2SO4)=n(SO2)+n(FeSO4)=0.2mol+0.2mol=0.4mol,假设标准状况下物质的量为0.2mol全为H2,消耗n(H2SO4)=n(SO2)+n(FeSO4)=0mol+0.2mol=0.2mol,所以参加反应的H2SO4物质的量在0.2mol~0.4mol,根据m=nM计算,质量为0.2mol×98g/mol~0.4mol×98g/mol,即196g~392g,
答:参加反应的H2SO4质量为196g~392g.
点评 本题考查根据方程式的计算、氧化还原反应等,熟练应用相关的计算公式以及原子守恒、电子守恒是解题关键,注意(1)(3)为并列问题,不能用(1)数据计算(3),(3)的值为区间值,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
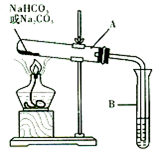 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
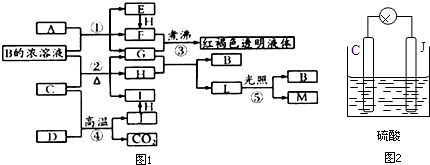
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
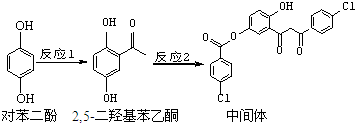
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以焦炭和二氧化硅为原料生产单质硅 | |
| B. | 以氨气为原料生产硝酸 | |
| C. | 电解氯化镁溶液生产金属镁 | |
| D. | 电解熔融氯化钠生产金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 半径 | 键的极性 | 沸点 |
| H-Cl>H-I | Cl-<Br- | H-Cl>H-Br | HF>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com