
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
分析 (1)未破坏化学键说明没有发生化学反应或没有电解质熔融或溶于水,属于物理变化;仅离子化合物溶于水或熔融或发生化学反应离子键被破坏;仅共价键被破坏说明原子晶体熔融或共价化合物(或单质)溶于水以及发生化学反应;离子键和共价键同时被破坏说明该物质发生化学反应;
(2)影响晶体晶格能大小的因素有离子半径以及离子所带电荷的多少,晶格能越大熔点越高;
解答 解:(1)①I2升华 ⑤O2溶于水未破坏化学键;烧碱融化③NaCl溶于水仅离子键被破坏;④HCl溶于水发生电离,仅共价键被破坏;⑥Na2O2 溶于水生成氢氧化钠和氧气,离子键和共价键同时被破坏,故答案为:①⑤;②③;④;⑥;
(2)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,故答案为:MgO>CaO>NaCl>KCl.
点评 本题考查了化学键的破坏,明确化学键被破坏的条件是解本题关键,再结合微粒间存在的作用力分析解答,注意有化学键被破坏不一定发生化学反应,但发生化学反应化学键一定被破坏.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
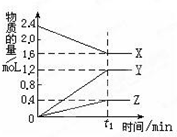 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的 |
| A | 溴乙烷在氢氧化钠溶液存在下加热水解后,加入硝酸银溶液 | 可用于检验溴元素的存在 |
| B | 苯中有少量苯酚,加入氢氧化钠溶液后,分液 | 可用于除去苯中的苯酚 |
| C | 乙烷中有少量乙烯,通入酸性KMnO4溶液中 | 可用于除去乙烷中的乙烯 |
| D | 测乙烯与溴水反应前后的pH | 可验证发生的是加成反应还是取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com