
下列说法中正确的是 ( )
A.所有主族元素的正化合价数,等于它的族序数
B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.第ⅠA、第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
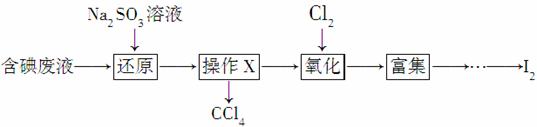
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;该操作将I2还原为I-的目的是________。
(2)操作X的名称为________。
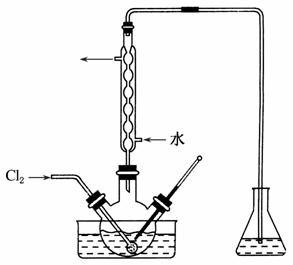
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如右图所示)。
实验控制在较低温度下进行的原因是__________;锥形瓶里盛放的溶液为__________。
(4)已知:5SO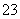 +2IO
+2IO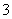 +2H+===I2+5SO
+2H+===I2+5SO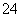 +H2O
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO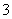 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO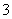 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在________________________。
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语或模型表示不正确的是
A.中子数为14的硅原子: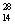 Si
Si
B.CH4分子的比例模型:
C.聚乙烯的结构简式: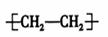
D.次氯酸分子的结构式:H—O-Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
甲在常温时为离子晶体,由X、Y两种元素组成,在甲中Xm+和Yn-的电子结构相同,甲、乙、丙、丁、
戊之间有如下反应关系
①甲+H2O H2↑+乙+丙↑
H2↑+乙+丙↑
②H2+丙—→丁气体
③乙+丙—→甲+戊+H2O
④戊+丁—→甲+己酸性
甲、戊、己依次是
A.NaCl、NaClO、HClO B .Na2S、Na2SO3、H2SO3
.Na2S、Na2SO3、H2SO3
C.CaCl2、CaClO2、HClO D.K2S、K2SO3、H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,
充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,
P的单质常用作电脑的芯片材料。
A.元素Y、P的简单氢化物中化学键类型相同
B.原子半径:X>Y
C.最高价氧化物的水化物酸性:P<Q
D.X、Q两元素的最高正化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增 大的四种短周期
大的四种短周期
元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
|
| Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 
;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101Kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419KJ,该反应的热化学方程式是  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在298K时下述反应的有关数据:
C(s) +1/2 O2(g) =CO(g) △H1=-110.5kJ/mol
C(s) +O2(g) =CO2(g) △H 2=-393.5kJ/mol
则C(s) +CO2(g) =2CO(g) 的△H 为
A.283kJ/mol B.-504 kJ/mol
C.-172.5kJ/mol D.172.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
使5.6 L CO2气体迅速通过Na2O2固体后得到4.48 L(标准状况下)气体,这4.48 L气体的质量是 ( )
A.6.4 g B.8.2 g C.6.2 g D.8.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com