
分析 (1)已知:
①CO(g)+2H2(g)=CH3OH(g)△H1=-100.46kJ/mol
②2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
依据已知的热化学方程式和盖斯定律进行计算;
(2)该燃料电池中,氧气在正极得电子,负极上二甲醚失电子发生氧化反应生成二氧化碳.
解答 解:(1)已知:
①CO(g)+2H2(g)=CH3OH(g)△H1=-100.46kJ/mol
②2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
根据盖斯定律:②-①×2得:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2=-204.7kJ/mol-(-100.46kJ/mol)×2=-3.78kJ/mol;
故答案为:-3.78kJ/mol;
(2)该燃料电池中,氧气在正极得电子,则通入氧气的电极是电源的正极,负极上二甲醚失电子发生氧化反应生成二氧化碳,则负极反应式为:CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:正;CH3OCH3+3H2O-12e-=2CO2↑+12H+.
点评 本题考查了盖斯定律的计算、电化学原理,熟悉盖斯定律、发生的电极反应即可解答,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
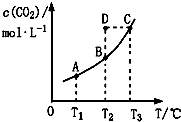
| A. | 该反应的△H<0 | |
| B. | 在T2时,D点的反应速率:ν(正)<(逆) | |
| C. | A、C两点相比,混合气体的平均相对分子质量:M(A)<M(C) | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生放热反应 | |
| D. | CaO+H2O═Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Br- | B. | SO32-、Al(OH)4-、K+、Al3+ | ||
| C. | Fe3+、Na+、NO3-、CO32- | D. | NH4+、Na+、SiO32-、I- | ||
| E. | Ca2+、Na+、NO3-、PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1CO32-的溶液:Na+、Al3+、NO3-、S2- | |
| B. | 无色溶液:K+、H+、SCN-、SO42- | |
| C. | $\frac{Kw}{c{(H}^{+})}$=0.1mol/L的溶液:Na+、K+、HCO3-、NO3- | |
| D. | 在由水电离出的c(H)=1.0×10-13mol•L-1的溶液中:Na+、Fe3+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
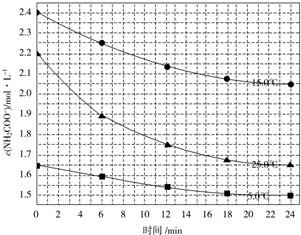
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com