
下列说法正确的是( )
A.将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中 c(HA) >c(Cl-) >c(A-)>c(OH-)
B.相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大
C.室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va∶Vb=10∶9。
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
A
【解析】
试题分析:A、将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,二者反应,反应后混合液的成分为NaA、HA和NaCl,浓度均为0.05mol/L ,存在NaA的水解平衡和HA的电离平衡,又混合后溶液显碱性,则NaA的水解程度大于HA的电离程度,微粒浓度关系为c(HA) >c(Cl-) >c(A-)>c(OH-),正确;B、氨水中存在平衡NH3·H2O 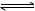 NH4++OH-,加入适量的氯化铵晶体后,NH4+浓度增大,平衡向左移动,OH-浓度减小,pH减小,向氢氧化钠溶液中加入适量的氯化铵晶体后,NH4++OH-=NH3·H2O,OH-浓度减小,pH减小,错误;C、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,所得混合液的pH=3,则酸过量,则混合液中C(H+)=(0.001Va -0.001Vb)/ (Va+Vb
)=0,0001mol/L,解得Va:Vb=11:9,错误;D、由0.1mol/L NaHB溶液pH为4知,H2B为弱酸,则NaHB溶液中存在HB-的水解平衡和电离平衡:HB-+H2O
NH4++OH-,加入适量的氯化铵晶体后,NH4+浓度增大,平衡向左移动,OH-浓度减小,pH减小,向氢氧化钠溶液中加入适量的氯化铵晶体后,NH4++OH-=NH3·H2O,OH-浓度减小,pH减小,错误;C、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,所得混合液的pH=3,则酸过量,则混合液中C(H+)=(0.001Va -0.001Vb)/ (Va+Vb
)=0,0001mol/L,解得Va:Vb=11:9,错误;D、由0.1mol/L NaHB溶液pH为4知,H2B为弱酸,则NaHB溶液中存在HB-的水解平衡和电离平衡:HB-+H2O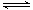 H2B +OH-,HB-
H2B +OH-,HB-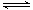 H++B2-且电离程度大于水解程度,HB-的电离和水解是微弱的,离子浓度关系为:c(HB-)>c(B2-)>c(H2B),错误。
H++B2-且电离程度大于水解程度,HB-的电离和水解是微弱的,离子浓度关系为:c(HB-)>c(B2-)>c(H2B),错误。
考点:考查电解质溶液中微粒浓度大小比较、强酸强碱混合pH计算。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com