
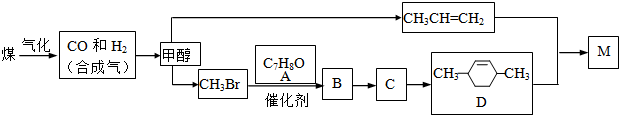
ú�������Ƶü״��������Ǻϳɾۺ���M��·��ͼ��

��֪�������廯���ﱽ���ϵ���ԭ�ӿɱ�±�����е����ȡ�����磺
���������գ�
��1����·��ͼ���й����ʵ�˵��������� ��ѡ����ţ���
a���Ӻϳ�����Ҳ�ɻ�úϳɰ���ԭ��H2 b���״��ɷ���ȡ������������ȥ�ȷ�Ӧ
c��Ҳ����ʯ�ͷ���ķ�����ñ�ϩ d�����÷���ķ�����ú�����л��A
��2��ͨ��ʵ���ҿ��ü״��� �Ʊ�CH3Br��
��3��C����D�ķ�Ӧ������ �� д��M�Ľṹ��ʽ ��
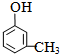
��4��ȡ1.08g A���ʣ�ʽ��108��������������ˮ��ȫ��Ӧ������3.45g��ɫ������д��A�Ľṹ��ʽ ��
��1��b��c��2�֣���1�֣�
��2��Ũ���ᡢ�廯�� ��1�֣���һ�����÷֣�д������۷֣�
��3��Ũ���ᣬ���� ��1�֣���һ�����÷֣�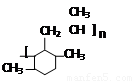 ��2�֣�
��2�֣�
��4��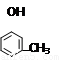 ��2�֣�
��2�֣�
��������
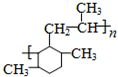
���������һ�������£�������һ����̼��Ӧ���ɼ״����״��������ᷢ��ȡ����Ӧ����һ����飬�ڴ��������£�һ�����ͺ�A��Ӧ����B��B��Ӧ����C��C��Ӧ����D������A�ķ���ʽ֪��A�к��д��ǻ����Ǽ�����ͷ��ǻ�������D�Ľṹ��ʽ֪��A�к��м��ͷ��ǻ����ӷ���ȡ����Ӧʱȡ��λ��Ϊ���ǻ����ڶ�λ������D֪��A�Ǽ�����ӣ�������Ӻ�һ����鷴Ӧ����B��2��5-�������ӣ���2��5-�������Ӻ����������ӳɷ�Ӧ����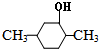 ��
��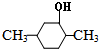 ������ȥ��Ӧ����
������ȥ��Ӧ���� ��
�� �ͱ�ϩ�����ӳɷ�Ӧ����M��M�Ľṹ��ʽΪ��
�ͱ�ϩ�����ӳɷ�Ӧ����M��M�Ľṹ��ʽΪ��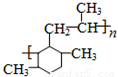
��1��a����������ͼ֪���Ӻϳ�����Ҳ�ɻ�úϳɰ���ԭ��H2������ȷ��
b���״��ɷ���ȡ����������Ӧ�����ܷ�����ȥ���ʴ���
c��Ҳ����ʯ�Ͳ�ȡ�ѻ����ѽ�ķ�����ñ�ϩ���ʴ���
d��ú�����к��м�����ӣ����Կ��÷���ķ�����ú�����л��A������ȷ����ѡb��c��
��2��ͨ��ʵ���ҿ��ü״���Ũ���ᡢ�廯����ȡһ����飬�ʴ�Ϊ��Ũ���ᡢ�廯�ƣ� 
��3����Ũ���������������������£�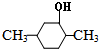 ������ȥ��Ӧ����
������ȥ��Ӧ���� ��M�Ľṹ��ʽΪ��
��M�Ľṹ��ʽΪ�� ���ʴ�Ϊ��Ũ���ᡢ���ȣ�
���ʴ�Ϊ��Ũ���ᡢ���ȣ� ��
��
��4��ȡ1.08g A���ʣ�ʽ��108�������ʵ���=0.01mol��������������ˮ��ȫ��Ӧ������3.45g��ɫ����������̼ԭ���غ�֪����ɫ���������ʵ�����0.01mol�����ɫ������Ħ��������345g/mol��A��ʽ���Ͱ�ɫ������ʽ�����237������ԭ��ȡ�����ǻ����ڶ�λ������A�Ľṹ��ʽΪ��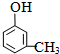 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���㣺���⿼���л�����ƶϣ���ȷ���ʷ�Ӧǰ������ŵı仯�ǽⱾ��ؼ������ݹ����ŵı仯ȷ����Ӧ������ע���������Ϣ���з�������ѶȽϴ�


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
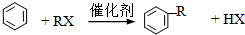


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� | �״� | ���ͣ�C8H8�� | һ����̼ |
| ȼ����/kJ?mol-l | 725 | 5518 | 283 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 CH3OH
CH3OH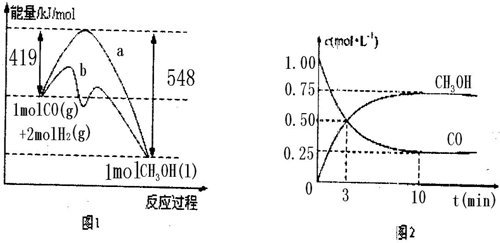
| 3 |
| 2 |
| 3 |
| 2 |
 CH3OH��g����H��0��ƽ�ⳣ��Ϊ
CH3OH��g����H��0��ƽ�ⳣ��Ϊ| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com