
100 mL 2 mol/L 盐酸与足量锌粒反应,能加快该反应速率又不影响生成氢气的量的物质是
A.6 mol/L盐酸 B.醋酸钠固体 C.硫酸铜溶液 D.金属钠
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b.c.d与氢形成的化合物中化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A化学反应必然伴随能量变化。
B、需加热才能发生的化学反应一定是吸热反应。
C、化学反应中的能量变化主要是由化学键的断裂和形成引起的。
D、反应物与生成物总能量的相对大小决定反应是吸热或放热。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A、CH4(g) + 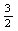 O2(g) == CO(g) +2H2O(l) ΔH== -akJ·mol—1 ,
O2(g) == CO(g) +2H2O(l) ΔH== -akJ·mol—1 ,
这里ΔH代表燃烧热
B、在250C、101kPa,1mol硫和2mol硫的燃烧热相等
C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
向0.l mol/L CH3COOH溶液中加入少量CH3COONa晶体时,会引起
A.溶液的pH增大 B.CH3COOH电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-) 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.50 mol N2O4气体通入到体积为5.0 L的真空密闭容器中立即出现红棕色,反应进行到2秒时,NO2的浓度为0.02 mol/L,60秒时体系已达平衡,此时容器内压强为开始的1.6倍,下列说法正确的是
A、前2秒以N2O4的浓度变化表示的平均反应速率为0.010 mol/(L·s)
B、在2秒时体系内压强为开始时的1.1倍
C、平衡时体系内含N2O4 为0.25mol
D、平衡时如果压缩容器体积,则可以提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应如下:2A(g)+B(g)2D(g)
ΔH=-Q kJ·mol-1。相关条件和数据见下表:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/kJ | Q1 | Q2 | Q3 |
下列说法正确的是( )
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时v(D)为0.005 mol·L-1·min-1
C.由表中信息可知Q>0,并有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,达平衡时c(D)为1.0 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com