
 ���ྻú�������о����������൱�ձ飮
���ྻú�������о����������൱�ձ飮���� ��1����H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H1=-241.8kJ•mol-1��C��s��+$\frac{1}{2}$O2��g���TCO��g����H2=-110.5kJ•mol-1��-�ٵõ���C��s��+H2O��g��=CO��g��+H2��g�������ݸ�˹���������㣻
��2���ٷ�Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯�����ɴ˽����жϣ�
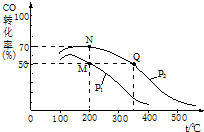
�������¶�CO��ת���ʼ�С���ݴ��жϷ�Ӧ���������������ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת��������
��K=$\frac{����������ƽ��Ũ��ϵ������֮��}{������Ӧ��ƽ��Ũ��ϵ������֮��}$����ѧƽ�ⳣ��ֻ���¶��йأ���ͬ�¶�ʱ��ƽ�ⳣ����ȣ������¶�ƽ�����淴Ӧ�����ƶ�����ƽ�ⳣ����С��
��M��ʱ��COת����Ϊ50%����μӷ�Ӧ��n��CO��=10mol��50%=5mol����ʣ��5molCO�����ݷ���ʽ֪����ʣ��n��H2��=20mol-5mol��2=10mol������n��CH3OH��=5mol��N��ʱ��COת����Ϊ80%���μӷ�Ӧ��n��CO��=10mol��80%=8mol����ʣ��2molCO�����ݷ���ʽ֪����ʣ��n��H2��=20mol-8mol��2=4mol������n��CH3OH��=8mol���ݴ˼��������ʵ���֮�ȣ�
��3�������Ȼ�ѧ����ʽ���ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
��� �⣺��1����H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H1=-241.8kJ•mol-1
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H2=-110.5kJ•mol-1
��-�ٵõ���C��s��+H2O��g��=CO��g��+H2��g�������ݸ�˹���ɵõ���H=-110.5kJ•mol-1+241.8kJ•mol-1=+131.3kJ•mol-1��
������ú̿�����Ȼ�ѧ����ʽΪC��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ•mol-1��
�ʴ�Ϊ��C��s��+H2O��g��=CO��g��+H2��g����H=+131.3kJ•mol-1��
��2����A��CO�ĺ������ֲ����ǻ�ѧƽ�����������A��ȷ��
B��v����CO��=v����CH3OH������˵�����淴Ӧ������ȣ��ﵽ��ƽ�⣬��B��ȷ��
C�������л�������ƽ����Է��������������������ʵ����ı�ֵ������ʼ���غ㣬���ʵ�����仯�����Ի�������ƽ����Է����������ֲ��䣬˵����Ӧ�ﵽ��ƽ�⣬��C��ȷ����ѡABC��
����ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��p1С��p2�������¶�CO��ת���ʼ�С��ƽ�������ƶ������Է�Ӧ�Ƿ��ȷ�Ӧ���ʱ�С���㣬
�ʴ�Ϊ����������
�ۻ�ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{{c}^{2}��{H}_{2}����c��CO��}$��Kֻ���¶��йأ���ͬ�¶�ʱ��ƽ�ⳣ����ȣ������¶�ƽ�����淴Ӧ�����ƶ�����ƽ�ⳣ����С������ͼ��֪���¶ȣ�M=N��Q������M��N��Q�����ƽ�ⳣ��KM��KN��KQ�Ĵ�С��ϵΪKM=KN��KQ��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OH��}{{c}^{2}��{H}_{2}����c��CO��}$��KM=KN��KQ��
��M��ʱ��COת����Ϊ50%����μӷ�Ӧ��n��CO��=10mol��50%=5mol����ʣ��5molCO�����ݷ���ʽ֪����ʣ��n��H2��=20mol-5mol��2=10mol������n��CH3OH��=5mol��N��ʱ��COת����Ϊ80%���μӷ�Ӧ��n��CO��=10mol��80%=8mol����ʣ��2molCO�����ݷ���ʽ֪����ʣ��n��H2��=20mol-8mol��2=4mol������n��CH3OH��=8mol�����������������ʵ����ʵ���֮��Ϊ��n��M������n��N����=��5+10+5��mol����2+4+8��mol=10��7��
�ʴ�Ϊ��10��7��
��3����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1
���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=$\frac{1}{2}$��[��-1275.6kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-442.8kJ•mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
���� ���⿼���˸�˹���ɵ�Ӧ�á�ת�������¶ȡ�ѹǿ��ϵ����ȷ�¶ȡ�ѹǿ�Ը÷�Ӧƽ��Ӱ���ǽⱾ��ؼ�����Ŀ�ۺ��Խ�ǿ���Ƕ�ѧ�������Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������г���N2��ƽ�������ƶ� | |
| B�� | �����¶���ʹ���������ܶ����� | |
| C�� | �÷�Ӧ��ƽ��ʱH2��ת����Ϊ20% | |
| D�� | �з���Ч�����ɴ�����N2��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
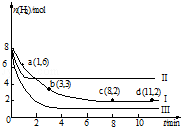 һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������
һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ��0��8 min��CO2��ƽ����Ӧ������ 0.375 mol•L-1•min-1 | |
| B�� | ����ʼʱ�����������г���3 mol CO2��4 mol H2����ƽ��ʱH2�������������20% | |
| C�� | ����ʼʱ�����������г���4 mol CO2��2 mol H2��2 mol CH3OH��1mol H2O��g�������ʱ��Ӧ������Ӧ������� | |
| D�� | �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
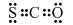 ������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ��xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol
������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ��xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol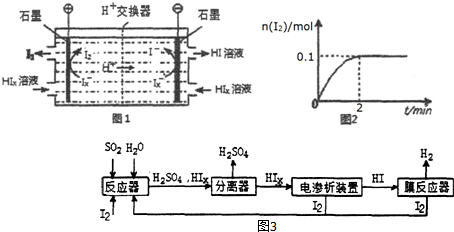
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| t/% | 0 | 2 | 4 | 6 | 8 |
| n��Cl2��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A�� | ��Ӧ��ǰ2s��ƽ������v��CO��=0.080mol/L/s | |
| B�� | ���������������䣬�����¶ȣ�ƽ��ʱc��Cl2��=0.11mol/L | |
| C�� | T Kʱ��ʼ�������г���0.9molCOCl2/0.10molCO����Ӧ�ﵽƽ��ǰv��������v���棩 | |
| D�� | T Kʱ��ʼ�������г���1.0molCl2��0.9molCO���ﵽƽ��ʱ��Cl2��ת����С��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{27m}{v}$mol/L | B�� | $\frac{m}{9v}$mol/L | C�� | $\frac{m}{27v}$mol/L | D�� | $\frac{m}{18v}$mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com