
| ||
| △ |
| ||
| △ |
| 8a |
| 29 |
| 8a |
| 29 |
| 浓硫酸 |
| △ |
| ||
| △ |
| 1 |
| 5 |
| 8a |
| 29 |
| 21a |
| 29 |
| ||
| 56g/mol |
| ||
| 16g/mol |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
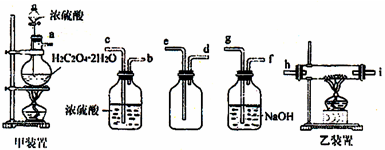
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g·cm—3 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
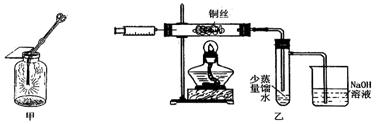
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
查看答案和解析>>
科目:高中化学 来源:09-10年万州二中高二下学期期末考试化学卷 题型:实验题
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
| | 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g·cm—3 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省威海市高三下学期第一次模拟考试化学试卷(解析版) 题型:填空题
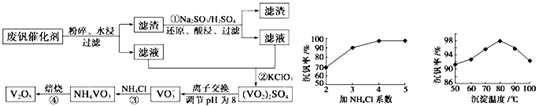
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:

已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) 2VO2++H2C2O4+2H+ = 2VO2+ + 2CO2↑+ 2H2O
回答下列问题:
(1)步骤①前,粉碎的目的是_________________________。
(2)步骤②中发生反应的离子方程式为__________________________。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.0mL,由此可知(VO2)2SO4溶液钒元素的含量为_________g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:09-10年万州二中高二下学期期末考试化学卷 题型:实验题
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。

(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
|
分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
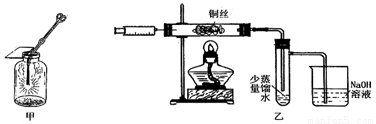
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com