
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
【答案】C
【解析】
A项,根据c(HC2O4-)=c(C2O42-)时溶液的pH计算H2C2O4的Ka2;
B项,根据图像知NaHC2O4溶液呈酸性,NaHC2O4溶液中HC2O4-的电离程度大于HC2O4-的水解程度,据此分析判断NaHC2O4溶液中离子浓度的大小顺序;
C项,由图像中0.1mol/LH2C2O4溶液中c(HC2O4-)分析H2C2O4的电离度;
D项,由电荷守恒和c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol/L分析。
A项,H2C2O4的电离方程式为H2C2O4![]() H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4-![]() H++C2O42-,H2C2O4的Ka2=
H++C2O42-,H2C2O4的Ka2=![]() ,根据图像当c(HC2O4-)=c(C2O42-)时溶液的pH介于4和5之间,H2C2O4的Ka2数量级为10-5,A项正确;
,根据图像当c(HC2O4-)=c(C2O42-)时溶液的pH介于4和5之间,H2C2O4的Ka2数量级为10-5,A项正确;
B项,根据图像知NaHC2O4溶液呈酸性,NaHC2O4溶液中HC2O4-的电离程度(HC2O4-![]() H++C2O42-)大于HC2O4-的水解程度(HC2O4-+H2O
H++C2O42-)大于HC2O4-的水解程度(HC2O4-+H2O![]() H2C2O4+OH-),但HC2O4-的电离程度和水解程度都很微弱,NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-),B项正确;
H2C2O4+OH-),但HC2O4-的电离程度和水解程度都很微弱,NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-),B项正确;
C项,H2C2O4的电离以第一步电离为主,已电离的H2C2O4分子的浓度等于溶液中c(HC2O4-),图像中0.1mol/LH2C2O4溶液中c(HC2O4-)<0.08mol/L,0.1mol/LH2C2O4溶液中H2C2O4的电离度为![]() ×100%<80%,C项错误;
×100%<80%,C项错误;
D项,加入NaOH溶液后溶液中的电荷守恒式为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),常温下pH=7.0的溶液呈中性,c(H+)=c(OH-),则pH=7.0的溶液中的电荷守恒为c(Na+)=c(HC2O4-)+2c(C2O42-),将c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol/L代入得c(Na+)=0.1+c(C2O42-)-c(H2C2O4),D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸的说法不正确的是
A. 光照易分解
B. 露置于空气中溶液浓度降低
C. 能与碳反应说明其具有强氧化性
D. 常温下铜在浓硝酸中发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物有很多,用途很广。如磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态锡原子的价电子排布式为_________,据此推测,锡的最常见正价是_________ 。
(2)磷化铜与水反应产生有毒的磷化氢(PH3),PH3分子的中心原子的杂化方式是_________ 。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn____P(填“>”“<”或“=”)。
(4)比较S、P的第一电离能I1(S)____I1(P)(填“>”“<”或“=”)。某磷青铜晶胞结构如下图所示:

(5)该晶体中P原子位于_______空隙中。
(6)若晶体密度为ag/cm3,P与最近的Cu原子核间距为______pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硝酸钾在黑火药中起________剂的作用。
(2)硝酸钾受热分解的化学反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
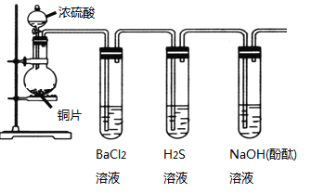
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
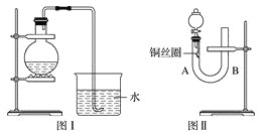
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)在量取浓盐酸时宜选用下列量筒中的________。
A.5 mL B.10 mL
C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面最低处与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构、元素性质的说法正确的是( )
A. ⅠA族元素是同周期中金属性最强的元素
B. 非金属元素组成的化合物中只含共价键
C. 同种元素的原子均有相同的质子数和中子数
D. S、Cl的含氧酸的酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com