
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答 解:A.根据总反应可知Zn被氧化,失去电子为原电池的负极,故A错误;
B.原电池中,电子由负极锌经外电路流向正极MnO2,故B正确;
C.不使用氢氧化钾,电解质导电能力差,影响电流,故C错误;
D.MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故D正确;
故选BD.
点评 本题考查化学电源的工作原理,侧重于学生的分析能力和综合运用电化学知识的考查,题目难度不大,注意电极反应方程式的书写和判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 该反应常温下不能自发进行,因此需要高温和催化剂 | |
| C. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| D. | 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53 | B. | 78 | C. | 25 | D. | 184 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4 g | B. | 15.4 g | C. | 4.4 g | D. | 12.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
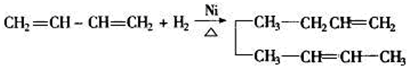
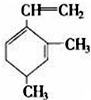 ,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.
,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.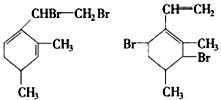
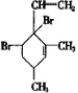
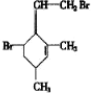
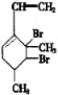 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com