
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
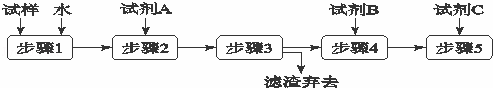
|
| A. | 步骤3的操作名称是过滤 |
|
| B. | 步骤1所需玻璃仪器是烧杯和玻璃棒 |
|
| C. | 试剂A是BaCl2溶液 |
|
| D. | 加入试剂A 的目的是除去CO32﹣并避免对Cl﹣或OH﹣的检验的干扰 |
| 物质的检验和鉴别的实验方案设计. | |
| 专题: | 实验设计题. |
| 分析: | 检验碳酸钾粉末中含有少量氯化钾和氢氧化钾,由实验流程可知,加水均溶解,步骤1为溶解,步骤2中加试剂A为硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子,以此来解答. |
| 解答: | 解:检验碳酸钾粉末中含有少量氯化钾和氢氧化钾,由实验流程可知,加水均溶解,步骤1为溶解,步骤2中加试剂A为硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子, A.由上述分析可知,步骤3的操作名称是过滤,过滤除去碳酸钡,故A正确; B.步骤1为溶解操作,所需玻璃仪器是烧杯和玻璃棒,故B正确; C.试剂A是硝酸钡,若加BaCl2溶液,干扰氯离子的检验,故C错误; D.加入试剂A为硝酸钡,其的目的是除去CO32﹣并避免对Cl﹣或OH﹣的检验的干扰,故D正确; 故选C. |
| 点评: | 本题考查物质的检验实验方案的设计,为高频考点,把握流程中发生的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意离子检验的分析与应用,题目难度不大. |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH===CHR2,被氧化为 被氧化为
被氧化为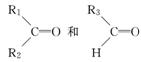 ,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有( )
,由此推断分子式为C4H8的烯烃在该条件下的氧化产物有( )
A.2种 B.3种 C.4种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
|
| A. | 烧杯中有铜无铁 | B. | 烧杯中有铁无铜 | C. | 烧杯中铁、铜都有 | D. | 烧杯中铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
|
| A. | Al2O3 | B. | MgO | C. | SiO2 | D. | P2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.[已知Ba(HCO3)2可溶于水]
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:
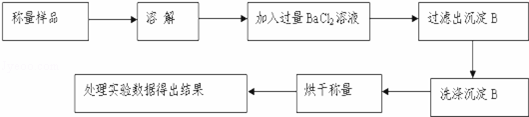
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 .
(2)洗涤沉淀B的操作是 .
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为 .
(4)烘干后的沉淀应放在 (仪器名称)中冷却至室温再称量.
方案Ⅱ:乙组同学的主要实验流程图如下:
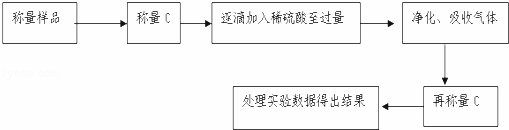
按如下图所示装置进行实验:
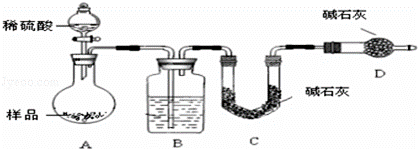
(5)该实验中装置B盛放的物质是 ,分液漏斗中如果用盐酸代替硫酸测量结果将 (填“偏大”、“偏小”、“无影响”).
(6)在C中装碱石灰来吸收净化后的气体.D装置的作用是 吸 .
(7)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是 .
方案Ⅲ:气体分析法
(8)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用 (以
下选项中选择)使测量误差较小.
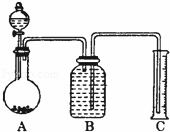
a饱和碳酸钠溶液 b饱和碳酸氢钠溶液c饱和氢氧化钠溶液 d饱和硫酸铜溶液
(9)但选用该溶液后实验结果仍然不够准确,其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应
式是:Zn+2OH--2e-===ZnO+H2O; Ag2O+H2O+2e-===2Ag+2OH- 下列说法
正确的是
A.Zn为正极,Ag2O为负极
B.Ag2O发生还原反应
C.原电池工作时,正极区溶液pH值减小
D.原电池工作时,负极区溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实
验方案。 。
实验二: 制取水合肼。(实验装置如右图所示)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)

(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数
为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实
验方案。 。
实验二: 制取水合肼。(实验装置如右图所示)控制反应温度,将分液漏斗中溶液缓慢滴入
三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)

(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com