
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+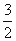 C(s)=
C(s)= 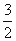 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: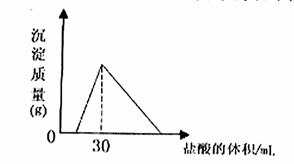 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
【知识点】离子方程式 反应热 电化学 计算 A 2B1 F3 F2
【答案解析】

解析:⑴根据金属铝将水体中的NO 转化为N2,及该反应中涉及的粒子有:H2O、Al、OH
转化为N2,及该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,知反应物有Al、NO
、N2,知反应物有Al、NO ,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH
,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH ,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
⑵根据总反应4Al+3O2+6H2O=4Al(OH)3知电池正极的电极反应式为2H2O+O2+4e-=4OH-
⑶根据盖斯定律:①÷2+②-③×3/2得2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
⑷根据图像可知,盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,根据n(NaCl)=n(HCl)=0.06mol,则n(Na)=0.06mol,根据图像可知,氢氧化钠应该是过量的,过量的氢氧化钠是0.02L×1mol/L=0.02mol,则根据钠原子守恒知偏铝酸钠的物质的量为0.06mol-0.02mol=0.04mol,0.06mol钠与水反应生成氢气0.03mol,生成0.04mol的偏铝酸钠的同时生成氢气0.06mol,即生成氢气共0.09mol,为2.016L。
【思路点拨】氧化还原反应的配平技巧:如本题的第⑴题的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物,再根据电荷守恒确定右边却OH-,最后根据原子守恒配平;根据终态法结合守恒解计算题:即本题的盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,然后根据守恒法解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
合成氨工业、硫酸工业的生产工艺 流程如图所示 。
。

合成塔和接触室中的反应分别为
N2(g)+3H2(g) 2NH3(g) ΔH<0;
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
(1)写出流程中设备的名称:B________,X________。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是___________________。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是________(填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是_______________。
(5)工业生产中常用氨-酸法进行尾气脱硫,以达到消 除污染、
除污染、 废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是___________________。
废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是___________________。
(6)根据化学 平衡移动原理,下列条件或措施合理的是________(填序号)。
平衡移动原理,下列条件或措施合理的是________(填序号)。
①合成氨工业在高压下进行
②合成氨工业和硫酸工业都使用催化剂
③及时将氨液化而分离
④硫酸工业中,净化后的炉气中要有过量空气
⑤合成氨工业和硫酸工业都采用适宜的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 。
(2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)
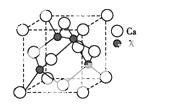
请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程
的反应式: NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若 产生0.2mol气体,则转移电子的物质的量是 mol。
产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在P+CuSO4+H2O—→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于摩尔质量的说法正确的是( )
A.水的摩尔质量是18 g
B.2 mol水的摩尔质量是1 mol水摩尔质量的2倍
C.任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
D.水的摩尔质量是氢气摩尔质量的9倍
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,m g A气体和n g B气体的分子数相同。下列说法不正确的是 ( )
A.同体积气体A和气体B的质量比为m∶n
B.25℃时,1 kg气体A和1 kg气体B的分子数之比为n∶m
C.同温同压下,气体A和气体B的密度之比为n∶m
D.标准状况下,等质量的气体A和气体B的体积之比为n∶m
查看答案和解析>>
科目:高中化学 来源: 题型:
重水A和普通水B分别跟足量的金属钠反应,下列说法正确的是
A.A、B质量相等时,产生气体的体积在同温、同压下相等
B.A、B质量相等时,产生气体的质量相等
C.A、B的物质的量相等时,产生气体的体积在同温、同压下相等
D.A、B的物质的量相等时,产生气体的质量在同温、同压下相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物 B.福尔马林、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质 D.稀豆浆、硅酸、氯化铁溶液均为胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com