
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3的制备分两步进行,反应的化学方程式如下:
i. 2Na +2NH3![]() 2NaNH2+ H2 ii. NaNH2+ N2O
2NaNH2+ H2 ii. NaNH2+ N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装置模拟工业级NaN3的制备。

(1)装置A用于制取NH3,右图装置I和Ⅱ为气体发生装置。若选用装置I,则发生反应的化学方程式为_________________________________;若选用装置Ⅱ,则试剂X是___________(填试剂名称),仪器a的名称是___________。
(2)装置B的作用是_______________________________________________________。
(3)加热前需要先往装置C中通一段时间NH3的目的是______________________________。
(4)当观察到装置C中熔融钠单质的银白色光泽全部消失时,停止通氨气,开始通入N2O。装置C中的Y为___________(填字母)。
A.冷水浴 B.热水浴 C油浴
(5)该实验装置的缺陷是_________________________________(任写一点)。
(6)反应完全结束后,取出装置C中的混合物先后经加水、加乙醇、过滤、洗涤、干燥等操作得到NaN3固体,其中洗涤操作可用乙醚洗涤NaN3固体的原因___________。
(7)实验室用滴定法测定叠氮化钠产品中NaN3的质量分数:
操作方法:取2.500g产品配制成500.0mL溶液。取25.00mL溶液置于锥形瓶中,加入25.00mL0.1010mol·L-1(NH4)Ce(NO3)6溶液。充分反应后,稍稀释,加入4mL浓硫酸,滴入邻菲罗啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗(NH4)2Fe(SO4)2标准溶液的体积为14.80mL。
测定过程发生反应的方程式为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
产品中NaN3的质量分数为___________%(保留1位小数)。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 浓氨水 蒸馏烧瓶 干燥氨气 排出装置内的空气,防止Na与空气中的氧气发生反应而影响产率 C 没有尾气处理装置 NaN3不溶于乙醚 92.8%
CaCl2+2H2O+2NH3↑ 浓氨水 蒸馏烧瓶 干燥氨气 排出装置内的空气,防止Na与空气中的氧气发生反应而影响产率 C 没有尾气处理装置 NaN3不溶于乙醚 92.8%
【解析】
A装置为制取氨气装置,Ⅰ装置是氯化铵与氢氧化钙加热制取氨气,Ⅱ装置为浓氨水与生石灰制取氨气;B装置为干燥氨气,因为叠氮化钠(NaN3)固体易溶于水,所以必须保证干燥环境;C装置为制取叠氮化钠(NaN3)的装置。反应之前应该排出装置内的空气,防止Na与空气中的氧气发生反应而影响产率,同时应该有尾气处理装置;根据得失电子数相等列等式进行计算。
(1)装置A用于制取NH3,若选用装置Ⅰ,则发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,若选用装置Ⅱ用浓氨水与生石灰制取氨气;
CaCl2+2H2O+2NH3↑,若选用装置Ⅱ用浓氨水与生石灰制取氨气;
正确答案:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 浓氨水 蒸馏烧瓶
CaCl2+2H2O+2NH3↑ 浓氨水 蒸馏烧瓶
(2)A中产生的氨气中混有水蒸气,为防止Na与水蒸气反应,B中碱石灰的作用是干燥氨气;
正确答案:干燥氨气
(3)因为Na会与空气中的氧气反应,造成产品不纯影响产率,所以加热前需要先往装置C中通一段时间NH3排出装置内的空气;
正确答案:排出装置内的空气,防止Na与空气中的氧气发生反应而影响产率。
(4)根据已知i. 2Na +2NH3![]() 2NaNH2+ H2 ii. NaNH2+ N2O
2NaNH2+ H2 ii. NaNH2+ N2O![]() NaN3+H2O可知反应温度210℃-220℃,所以只能选择油浴加热;
NaN3+H2O可知反应温度210℃-220℃,所以只能选择油浴加热;
正确答案:C。
(5)该实验装置的缺陷是没有尾气处理装置会造成环境污染;
正确答案:没有尾气处理装置
(6)根据题干可知叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,乙醚洗涤叠氮化钠可减少叠氮化钠的损失;
正确答案:NaN3不溶于乙醚。
(7)根据已知可知Ce4+~NaN3 和Ce4+~Fe2+,Ce4+得电子数等于NaN3与Fe2+失电子数列等式计算,设产品NaN3的质量分数为x,则
25.00×0.1010×10-3=![]() ×
×![]() +0.0500×14.80×10-3计算得x=92.8%
+0.0500×14.80×10-3计算得x=92.8%
正确答案:92.8%。


科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是
A. SiO2![]() SiCl4
SiCl4![]() Si
Si
B. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
C. N2![]() NH3
NH3![]() NH4Cl(aq)
NH4Cl(aq)
D. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法错误的是

A. 左室电极为该电池的负极
B. 右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O
C. 左室电极附近溶液的pH增大
D. 工作时中间室的Cl-移向左室,Na+移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是
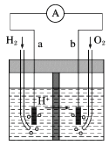
A. a极为负极,电子由a极经外电路流向b极
B. a极的电极反应式:H2-2e-===2H+
C. 电池工作一段时间后,装置中c(H2SO4)增大
D. 若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在不同物质的同种元素之间的是
A. 2H2S+SO2=3S↓+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. CuO+H2SO4=CuSO4+H2O
2KCl+3O2↑D. CuO+H2SO4=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+ +OH- ====H2O生成1 mol H2O放出热量57.3 kJ,下列反应中能放出57.3 kJ热量的是( )
A.1 mol稀H2SO4与足量NaOH溶液反应
B.稀盐酸与氨水反应生成1 mol H2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1 mol水
D.稀NaOH与95%浓硫酸反应生成1 mol水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示:

查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
金属离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀的pH | 4.2 | 6.5 | 1.4 |
沉淀完全的pH | 6.7 | 9.7 | 3.7 |
(1)电子工业中用FeCl3溶液制作铜制印刷电路板,该反应的离子方程式为___________。
(2)操作I、操作Ⅱ所用的玻璃仪器除烧杯外还需要______________________。
(3)氯酸钠的作用是____________________________________________;反应A中氧化剂与还原剂物质的量之比是___________。
(4)调节pH的范围为___________,可以选择的试剂是___________(填序号)。
A.氨水 B.硫酸铜 C.氧化铜 D.氢氧化铜
(5)已知滤液Ⅱ中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:___________。
(6)若废液中CuCl2的含量为13.5%,则1吨废液理论上可提炼碱式碳酸铜________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
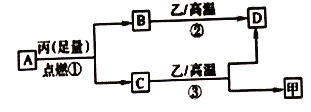
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com