
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,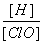 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有[Na+]=[Cl-]+[ClO-]
D.加入少量水,水的电离平衡向正反应方向移动
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ |
(1)元素 的单质室温下呈液态;元素 的氢化物最稳定;元素 的最高价氧化物的水化物的酸性最强;元素 的高价氧化物的水化物的碱性最强(填写“元素符号”);
(2)表中元素③与⑨形成稳定化合物的结构式是 ;
(3)表中元素①③⑤组成的“A4B2C2”型物质,分子内含有的键型是 ;
A.离子键和共价键 B.仅为共价键
C.仅为极性共价键 D.极性共价键和非极性共价键
(4)表中元素 的氢化物的分子间存在氢键(填写“数字序号”);
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
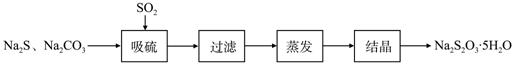
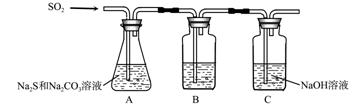 (1)吸硫装置如图所示。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有下列各离子组的溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯化氢:Ca2+、K+、NO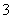 、Cl-
、Cl-
B.氯气:Na+、Al3+、Br-、SO
C.乙烯:K+、H+、SO 、MnO
、MnO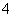
D.氨气:Ag+、Fe3+、Na+、NO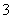
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性:IO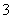 >Fe3+>I2;②KI+I2KI3
>Fe3+>I2;②KI+I2KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为四份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色沉淀的盐,可检验溶液中是否含有Fe2+,推测该蓝色沉淀是_______
(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:____________________、____________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)海水提溴的过程中不发生氧化还原反应 ( )
(2)可以用淀粉溶液检验加碘食盐中的KIO3 ( )
(3)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色 ( )
(4)碘易升华,可用加热升华法除去NH4Cl中混有的I2 ( )
(5)能使湿润的淀粉KI试纸变蓝的气体一定是Cl2 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______________________、________________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又 将Br2还原为Br-,其目的为________________________________________________________________________。
将Br2还原为Br-,其目的为________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:________________;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________________________________________________________________;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________;
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G在常温常压下为气体,E遇淀粉变蓝,K是一种常用的食品添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。

(1)B、I代表的物质的化学式分别为______________、______________。
(2)写出反应①、②的离子方程式:
①________________________________________________________________________;
②________________________________________________________________________。
(3)选出实验室保存C单质的注意事项________(A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞),除此之外还采取了什么特殊的保存方法:__________________________。
(4)已知A、C、E均能与G反应,其反应条件要求由高到低的顺序为________________(用化学式表示)。
(5)A与H溶液反应,其氧化产物和还原产物的物质的量之比为1∶1,写出此反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com